Лекция 01.
1. Что такое органическая химия?
1-1 Предмет органической химии Определение состава органических веществ
Тема 0. Задачи на определение состава веществ
- Найдите формулу вещества по данным элементного анализа:
a) Al – 75%, C- 25%
b) Н – 1,58%, N – 22,22%, O – 76,20%
c) Na – 42,07%, P – 18,91%, O – 39,02%
- Газообразное соединение азота и водорода содержит 12,5% водорода по массе, а плотность его паров по водороду равна 16. Найти молекулярную формулу этого соединения.
- При полном сгорании 2,66г вещества получилось 1,54г углекислого газа и 4,48г оксида серы (IV). Найти простейшую формулу этого вещества.
- В состав винного спирта входят углерод, водород и кислород. Определите его молекулярную формулу, если известно, что при сгорании 1,38г этого соединения образуется 2,64г углекислого газа и 1,62г воды, а плотность его паров по воздуху равна 1,59.
- Определите формулу соединения, если известно, что оно содержит 28% металла, 24% серы и 48% кислорода по массе.
- Соль содержит 31,8% калия, 39,2% кислорода, остальное – некоторый кислотообразующий элемент. Найдите формулу соли.
- Хлорид некоторого металла содержит 74,7% хлора. Определите неизвестный металл.
- Соль, содержащая некоторый элемент Х, имеет следующее массовое соотношение элементов: X:H:N:O = 12:5:14:48. Какова формула этой соли?
Тема 1. Определение состава органических веществ
1. Соединение с простейшей формулой C3H4O имеет плотность по водороду, равную 84. Его молекулярная формула:
А — C3H4O, B — C9H14NO4, C — C12H16O, D — C9H12O3, E — C8H8O4
2. Сколько граммов углекислого газа образуется при полном сгорании 28,52 г октана (С8Н18) в избытке кислорода?
А — 11,0 г, В — 22,0 г, С — 44,0 г, D — 88,0 г, E — 176,0 г
3. При сгорании 1,24 г органического вещеcтва в избытке кислорода образуется 1,76 г углекислого газа и 1,08 г воды. Определить простейшую формулу этого вещества.
A — CHO, B — CH2O, C — CH3O, D — C2H3O, E — C3H5O
4. При анализе органического соединения было обнаружено, что оно содержит только 0,566 г водорода, 2,641 г азота и 6,793 г углерода. Определите простейшую формулу этого соединения.
A — C3H3N, B — C6H6N, C — C12HN5, D — C2H7N, E — HCN
5. Определите простейшую формулу вещества, содержащего 14,28% водорода и 85,72 % углерода. Определите его молекулярную формулу, если плотность его паров равна 2,5 г/л (н.у.).
6. Определите простейшую формулу вещества, если при сгорании 7,2 г его получили 22 г углекислого газа и 10,8 г воды. Достаточно ли данных, чтобы определить молекулярную формулу этого вещества?
7. Сожгли 4,8 г органического вещества, при этом образовалось 3,36 л (н.у.) углекислого газа и 5,4 мл (н.у.) воды. Плотность паров вещества по водороду равна 16. Определите его молекулярную формулу. Есть ли в задаче лишние данные?
8. Сгорело 9 г вещества и образовалось 8,96 л (н.у.) углекислого газа, 12,6 г воды и 2,8 г азота. Определите простейшую и молекулярную формулы.
9. При полном сгорании органического вещества массой 18,0 г образовалось 20,16 л (при н. у.) углекислого газа и 21,6 г воды. Установите молекулярную формулу вещества
10. При сгорании 37,8 г органического вещества образовалось 66,0 г углекислого газа, 8,4 г азота и 16,2 г воды. Установите молекулярную формулу вещества, если известно, что его молярная масса меньше 240 г/моль.
11. При сгорании 4,48 л (н.у.) газообразного органического вещества получили 35,2 г углекислого газа и 10,8 мл воды. Плотность этого вещества составляет 2,41 г/л (н.у.).
На основании данных условия задачи:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу органического вещества;.
12. Некоторое органическое соединение содержит 40,0% углерода и 53,3% кислорода по массе. Плотность данного вещества по водороду равна 30.
На основании данных условия задачи:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу органического вещества
13. При сгорании 17,5 г органического вещества получили 28 л (н.у.) углекислого газа и 22,5 мл воды. Плотность паров этого вещества (н.у.) составляет 3,125 г/л.
На основании данных условия задачи:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу органического вещества
14. При сгорании 10,5 г органического вещества получили 16,8 л углекислого газа (н.у.) и 13,5 г воды. Плотность паров этого вещества (н.у.) составляет 1,875 г/л.
На основании данных условия задачи:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу органического вещества
15. При сгорании 26,6 г органического вещества образовалось 35,2 г углекислого газа, 2,8 г азота и 12,6 г воды. Установите молекулярную формулу вещества, если известно, что его молярная масса меньше 250 г/моль.
16. Определите молекулярную формулу углеводорода, если известно, что при полном сгорании 25,0 г этого соединения образовалось 36,0 г воды. Сколько граммов углекислого газа при этом образовалось?
17. Известно, что в приведенных ниже результатах анализа вещества Х один из результатов неверен: углерод — 31,9%, водород — 2,23%, сера — 14,2%, кислород — 24,15%, азот — 6,2%, хлор — 31,4%. Установите молекулярную формулу вещества Х, если известно, что его молярная масса примерно равна 220 г/моль.
18. Твердый остаток, полученный при сжигании 50 мг хлорофилла, в состав которого входят углерод, водород, кислород, азот и магний, растворен в 20 мл 0,01 М соляной кислоты. На нейтрализацию полученного раствора потребовалось 8,8 мл раствора гидроксида натрия с концентрацией 0,01 моль/л. Вычислите минимальное значение молярной массы хлорофилла.
19. Может ли органическое вещество содержать 40% водорода по массе? Ответ подтвердите расчетом.
20. В 1928 году американскому химику корпорации «Дженерал Моторс» («General Motors Research») Томасу Мидглей младшему удалось синтезировать и выделить в своей лаборатории химическое соединение, состоявшее на 23,53% из углерода,1,96% водорода и 74,51% фтора. Полученный газ был в 3,52 раза тяжелее воздуха и не горел. Выведите формулу соединения
21. При сжигании 3,6 г некоторого органического вещества было получено 3,6 г воды и диоксид углерода, при пропускании которого в 1500 мл раствора гидроксида кальция с концентрацией 0,1 моль/л образовалось 10,0 г осадка. Рассчитайте брутто-формулу исходного вещества, если его относительная молекулярная масса меньше 100.
Лекция 02. Строение органических соединений. Классификация и номенклатура
Видеозапись лекции. Теория строения органических веществ А.М.Бутлерова
1-2 История развития представлений о химической связи Теория Бутлерова Изомерия
1-5 Классификация и номенклатура органических соединений (общие принципы)
Тема 2. Состав и структура органических веществ. Изомеры
- Нарисуйте все изомеры для C4H10 и C5H12
- Нарисуйте все изомеры состава С4H9Cl.
- Сколько изомеров имеет соединение состава C3H6.
- Верно ли утверждение, что вещество состава C7H16 имеет 8 структурных изомеров? Если нет – то сколько изомеров у этого вещества?
- Может ли молекула углеводорода содержать нечётное число атомов водорода? Ответ обоснуйте.
- Органическое вещество содержит 14.34% C, 0.80% H и хлор. Плотность его паров 11.2 г/л при пересчете на нормальные условия. Определите его простейшую и молекулярную формулу и нарисуйте все его изомеры.
- Бензин — это смесь углеводородов, содержащих от 5 до 9 атомов углерода в \ молекуле. Качество бензина характеризуется так называемым октановым числом. Чем выше этот показатель, тем сильнее можно сжать смесь паров бензина с воздухом без взрыва (детонации) и, следовательно, тем мощнее может быть двигатель внутреннего сгорания. Октановое число зависит от строения углеводорода. Чем больше разветвлений в молекуле, тем выше октановое число. Составьте структурные формулы углеводородов состава C8Н18 с максимально большим и максимально маленьким октановыми числами.
- Анализ вещества, состоящего из углерода, водорода и хлора дал следующие результаты: 42.6% C, 7.1% H, 50.3% Cl. Определите молекулярную формулу вещества, зная, что в состав молекулы входят два атома хлора и напишите две возможных структурных формулы.
- При сжигании 2.3 г газообразного при 0 С и давлении 101.3 кПа вещества было получено 2.24 л углекислого газа и 2.7 мл воды. Какова структурная формула исследуемого вещества?
- При сжигании 2,2 г вещества получили 2,24 л (н.у.) углекислого газа и 1,8 г воды. Определите простейшую формулу и предложите возможные структуры вещества.
- Образец вещества с массой 3,10 мг сожгли и получили 4,40 мг углекислого газа и 2,70 мг воды. Плотность паров этого вещества по водороду — 31. Какова молекулярная и возможные структурные формулы этого вещества
- При сгорании 1,4 мг наркотического вещества Х получилось 4,4 мг углекислого газа и 1,8 мг воды. Известно, что пары Х примерно в полтора раза тяжелее воздуха, а все атомы углерода в молекуле равноценны по реакционной способности. Напишите молекулярную и структурную формулы вещества Х и назовите его.
- При сжигании 0,45 г соединения Х получено 0,88 г углекислого газа и 0,45 г воды. Известно, что плотность Х по водороду равна 45. Определите молекулярную формулу вещества Х, напишите уравнение его горения и две возможных структурных формулы.
- При сгорании 3,2 мг ядовитого вещества Х получилось 4,4 мг углекислого газа и 3,6 мг воды. Напишите молекулярную и структурную формулы вещества Х и назовите его.
- При сжигании 0,59 г соединения Х получено 1,32 г углекислого газа и 0,63 г воды. Известно, что плотность Х по водороду равна 59. Определите молекулярную формулу вещества Х, напишите уравнение его горения и две возможных структурных формулы.
- При сжигании 2,2 г вещества получили 2,24 л (н.у.) углекислого газа и 1,8 г воды. Определите состав и предложите возможные структуры вещества.
- Летучее органическое соединение А в процессе хроматографической очистки было загрязнено карбонатом кальция и в таком виде сдано на элементный анализ. При сожжении 108 мг образца загрязненного вещества было получено 78,4 мл углекислого газа (н.у.), 54 мг воды и 28 мг несгораемого остатка. Установите молекулярную формулу вещества А и предложите его возможные структурные формулы.
- Содержание углерода в газообразной смеси пентана с углеводородом Х составляет 85% по массе. Объем кислорода, необходимый для полного сгорания этой смеси, в 6,5 раза превышает объем смеси. Напишите структурные формулы всех возможных углеводородов, удовлетворяющих условию задачи
- При сожжении 1,64 г некоторого вещества X в избытке кислорода было получено 1,12 л углекислого газа, 1,26 мл воды (н.у.), а в трубке для сжигания осталось 1,06 г несгораемого остатка, представляющего собой карбонат натрия. Каким строением может обладать вещество Х? Приведите его возможные структурные формулы.
- (Мосгор 17-18) При сжигании 3,6 г некоторого органического вещества было получено 3,6 г воды и диоксид углерода, при пропускании которого в 1500 мл раствора гидроксида кальция с концентрацией 0,1 моль/л образовалось 10,0 г осадка. Рассчитайте брутто-формулу исходного вещества, если его относительная молекулярная масса меньше 100. Приведите для него все возможные структурные формулы, если известно, что его молекула содержит один цикл.
Тема 3. Классификация и номенклатура органических веществ
- В монохлоралкане массовая доля хлора равна 55,04%. Определите молекулярную формулу монохлоралкана.
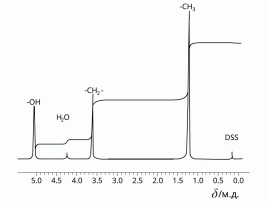
- Для определения строения органических соединений современные химики широко используют метод ЯМР. Он основан на том, что ядра некоторых атомов, в том числе обычных атомов водорода Н-1, способны взаимодействовать с магнитным полем, излучая определённую энергию. Величина этой энергии зависит от окружения атома в молекуле, т. е. от того, с какими атомами или группами атомов он связан. Наиболее ценную информацию для органической химии несут спектры на ядро атомов водорода-1 — протонный магнитный резонанс (ПМР). Спектр ПМР показывает, сколько разных типов атомов водорода находится в молекуле, число атомов данного типа и некоторую другую информацию о структуре молекулы.
Например, спектр ПМР этанола CH3-CH2-OH выглядит так:
ПМР-спектр этанола
1) Рассмотрите ПМР-спектр, сопоставьте его со структурной формулой этанола. Сколько типов атомов водорода присутствует в данной молекуле? Есть ли на спектре информация, показывающая число атомов каждого типа в молекуле?
2)Для исследования был взят чистый этанол или присутствовала примесь другого вещества? Обоснуйте ваш ответ.
3)Опишите, как должен выглядеть спектр ПМР для изомера этанола — диметилового эфира.
3. Напишите структурные формулы двух веществ разных классов состава С7Н14, определите число первичных, вторичных, третичных и четвертичных атомов углерода в обоих случаях и назовите вещества по систематической номенклатуре.
4. Напишите формулу двух веществ разных классов состава С4Н7Cl, определите число первичных, вторичных, третичных и четвертичных атомов углерода в обоих случаях и назовите вещества по систематической номенклатуре.
5. Углеводород, содержащий одну двойную и одну тройную связь (но не содержащий циклов), смешали с эквивалентным количеством кислорода и сожгли. После сгорания общее число молей в системе не изменилось. Определите структурную формулу углеводорода.
6. (Биофак 2003). В молекуле алкана содержится 9 первичных и 3 четвертичных атома углерода. Найдите число третичных атомов углерода.
7. При сжигании 11,48 г органического вещества Х образовалось 10,08 л углекислого газа и 6,75 мл воды (н.у.). Плотность его паров в пересчете на нормальные условия примерно равна 3,4 г/л. Определите молекулярную формулу вещества Х, предложите структурные формулы и названия его возможных изомеров, если известно, что вещество Х содержит 46,4% хлора.
8. При сжигании 22,60 г органического вещества Х образовалось 13,44 л углекислого газа и 10,80 мл воды (н.у.). Плотность его паров в пересчете на нормальные условия примерно равна 5 г/л. Определите молекулярную формулу вещества Х, предложите структурные формулы и названия его возможных изомеров, если известно, что вещество Х содержит 62,8% хлора.
- Органическое вещество Х содержит 47,06% углерода, 6,54% водорода и хлор. Плотность его паров по водороду в пересчете на нормальные условия примерно равна 38. Определите молекулярную формулу вещества Х, предложите структурные формулы и названия его возможных изомеров.
- Органическое вещество содержит 47,1% углерода и 6,5% водорода. После сплавления 1,53 г вещества А с избытком металлического натрия и последующей обработки реакционной смеси сначала избытком спирта, затем разбавленной азотной кислотой и избытком раствора нитрата серебра выпало 2,87 г хлорида серебра. Плотность паров вещества А в пересчете на нормальные условия примерно равна 3,4 г/л. Установите молекулярную формулу вещества А, предложите структурные формулы возможных изомеров и назовите их.
- Учащийся, называя соединения по номенклатуре, допустил ошибки. Найдите их, напишите структурные формулы соединений, о которых идёт речь, и приведите правильные названия этих веществ: а) 1,3-диметилпентан, б) 2-этилбутан, в) 4-метилпентан, г) 2-метил-3-этил-4-метилгексан, д) 1-карбоксипропанол-1, е) 2-метилпент-4-ен.
- Учащийся, называя соединения по номенклатуре, допустил ошибки. Найдите их, напишите структурные формулы соединений, о которых идёт речь, и приведите правильные названия этих веществ: а) 1,3-диметилпентан, б) 2-пропилбутан, в) 4-хлорпентан, г) 2-метил-3-этил-4-метилгексан, д) циклогексановая кислота е) 3-метил-гекс-5-ин.
Лекция 03
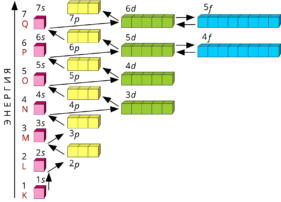
Видеозапись лекции. Модели атома
Видеозапись лекции. Квантовомеханическая модель атома. Электронные конфигурации
Тема 4 Строение атома и периодическая система
- Сколько электронов содержится на внешнем уровне атома серы?
- Приведите пример четырех частиц с электронной конфигурацией внешнего слоя 3s2 3p6.
- Могут ли электроны иона +К находится на следующих орбиталях: 2p, 4s, 2f, 4p? Ответ мотивируйте.
- Напишите электронную конфигурацию атома магния в первом возбужденном состоянии.
- Сколько элементов было бы в третьем периоде, если бы спиновое квантовое число имело единственное значение +1 (остальные квантовые числа имеют обычные значения)?
- Приведите примеры 4 частиц, электронная конфигурация которых совпадает с электронной конфигурацией аргона.
- В молекуле одного из алкенов находится 32 электрона. Установите его молекулярную формулу. Сколько различных изомерных алкенов соответствует данной формуле? Напишите их структурные формулы и назовите их.
Лекция 04
Видеозапись лекции. Часть 1. Что такое химическая связь?
Видеозапись лекции. Часть 2. Характеристики ковалентной связи
Видеозапись лекции. Часть 3. Геометрия молекул
1-4 Природа химических связей (современные представления)
Тема 5. Химическая связь
1.Сколько сигма и пи-связей содержит молекула гепта-1,3-диен-6-ина? Определите гибридизации всех атомов углерода в молекуле.
2.Какие связи являются полярными, а какие – неполярными в молекулах тетрафторэтена, пропена и этанола? Нарисуйте структурные формулы и обозначьте в них полярные и неполярные связи.
3.Формальдегид используют как консервант при изготовлении биологических препаратов. Запах водного раствора формальдегида — формалина — вы можете почувствовать везде, где есть «заспиртованные» препараты, например, в зоологических музеях или в Кунсткамере.
Молекулярная формула формальдегида — CH2O. Валентный угол близок к 120∘, длины связей равны для C = O — 0,122 нм, для С-Н — 0,110 нм. Молекула плоская, представляет собой треугольник с атомом углерода в центре.
Нарисуйте структурную формулу формальдегида. Рассчитайте расстояние между атомом кислорода и атомом водорода, между двумя атомами водорода в молекуле.
4.Определите общую формулу гомологического ряда углеводородов, имеющих одну двойную связь, две тройных связи и один цикл. Сколько сигма- и пи- связей содержит молекула вещества данного ряда, в состав которой входит п атомов углерода. Приведите пример структурной формулы такой молекулы, содержащей 11 атомов углерода.
5.Смесь 10 мл углеводорода Х и 70 мл кислорода подожгли электрической искрой. После полного сгорания и конденсации водяных паров объем газа составил 65 мл, а после пропускания через избыток раствора щелочи уменьшился до 25 мл. (Все объемы газов измерены при температуре 23оС и давлении 753 мм рт ст.) Установите молекулярную формулу вещества А и предложите возможные структурные формулы.
Лекция 05. Пространственная изомерия, электронные эффекты заместителей и классификация органических реакций
Видеозапись лекции. Оптическая изомерия
Видеозапись леции. Геометрическая изомерия