Научный руководитель: научный сотрудник лаборатории клеточного гемостаза и тромбоза ФНКЦ ДГОИ им. Д. Рогачева Подоплелова Н.А., куратор — Дегтярева А.П.
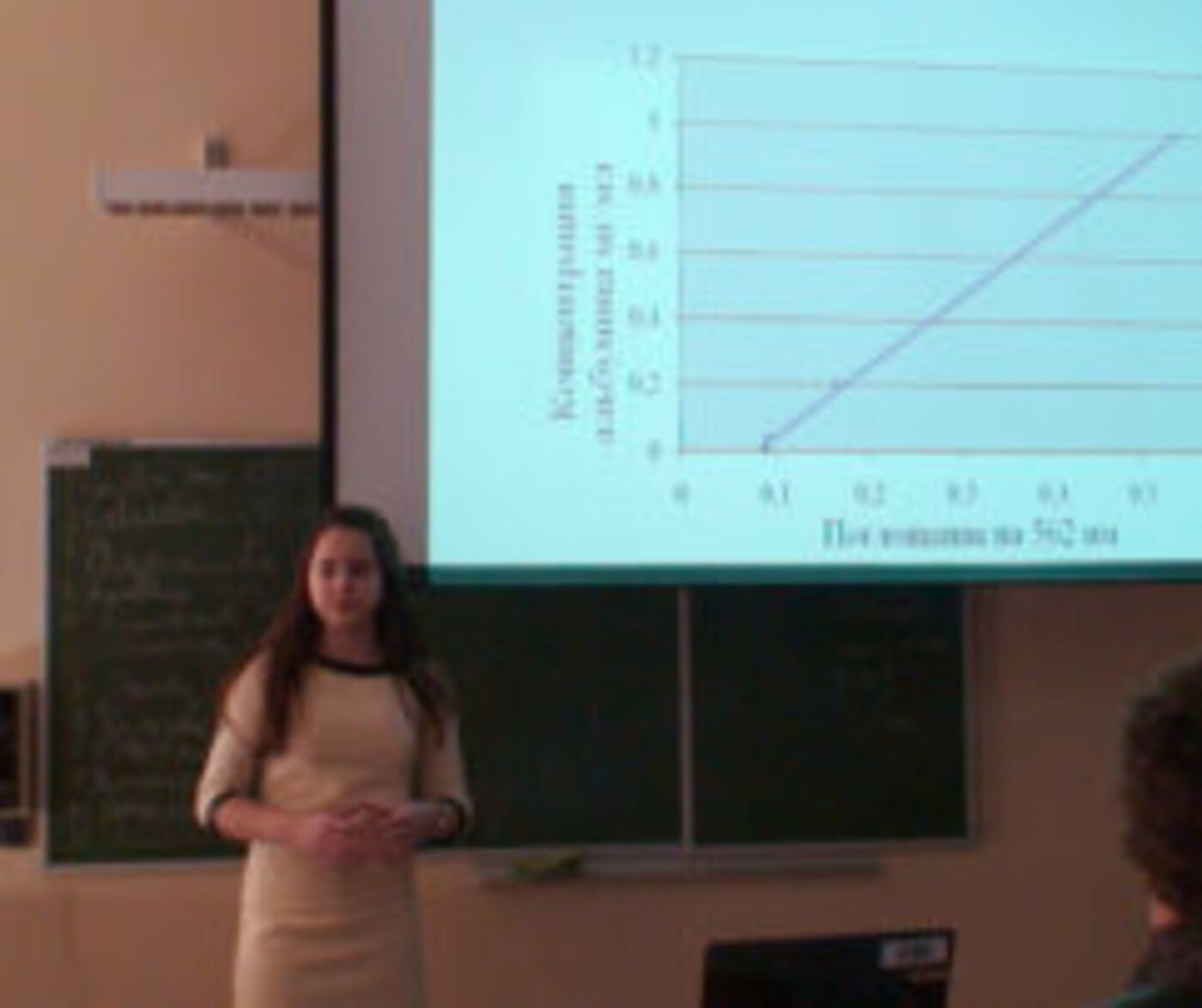
В современной медицине актуален вопрос борьбы с тромбозом. Одним из возможных способов достижения данной цели может служить ингибирование контактного пути активации свертывания крови, а именно фактора ХII. Данный фактор не играет заметной роли в поддержании гемостаза, Таким образом, новые препараты против тромбозов, ингибирующие фXII, будут безопасны с точки зрения риска кровотечения. Наиболее селективный ингибитор в отношении фХII является также ингибитором трипсина и был выделен из кукурузы. По аналогии мы предположили, что ингибитор фXII может содержаться в репе Brassica rapa, поэтому именно из репы мы выделяли белки, потенциальные ингибиторы фXII. Таким образом, целью данной работы является выделение и очистка белков – ингибиторов сериновых протеиназ из Brassica rapa. Экстракцию белков из биомассы проводили раствором NaCl (0,1%), затем подвергли экстракт тепловой обработке для того, чтобы избавиться от балластных белков. Дальнейшую очистку проводили методом аффинной хроматографии. Анализ чистоты выделенных белков и оценку их молекулярной массы осуществили методом электрофореза по Лэммли. В результате анализа выяснили, что с трипсином связываются два белка, молекулярные массы которых около 25 и 37 кДа соответственно. Концентрацию белков определяли методом Бредфорда, для этого построили калибровочный график зависимости поглощения бычьего сывороточного альбумина на 562 нм от его концентрации и определили, что концентрация белков из Brassica rapa 0,418 мг/мл. Также мы провели хромогенный тест для оценки ингибирующей способности выделенных белков по отношению к трипсину. Скорость расщепления субстрата трипсином в присутствии выделенных нами белков значительно ниже, чем скорость расщепления субстрата чистым трипсином. Это говорит о том, что выделенные из Brassica rapa белки ингибируют трипсин.
Таким образом, в ходе данной работы была получена смесь из двух белков с молекулярными массами около 25 и 37 кДа соответственно, способных ингибировать трипсин. Данные результаты открывают широкие возможности для создания новых антитромбических препаратов.