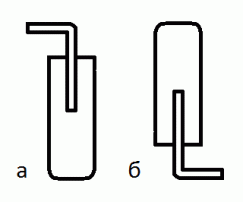♠ Техника безопасности
Водород горюч и в смеси с кислородом или воздухом образует взрывоопасную смесь. Все опыты с водородом разрешается проводить только в присутствии преподавателя, в очках или маске.
Если прибор, заполненный водородом, необходимо нагреть или поджечь водород на выходе из него, следует до начала нагревания вытеснить из прибора весь воздух водородом, затем проверить водород на чистоту.
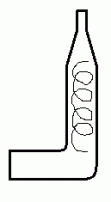
Проверка водорода на чистоту. Для этого надо приготовить две маленькие пробирки. Надеть на газоотводную трубку прибора сухую пробирку, примерно через 5 секунд медленно снять ее, закрыв отверстие пробирки большим пальцем, и поставить на ее место вторую пробирку. Держа пробирку с водородом отверстием вниз, поднести ее к пламени зажженной горелки. Отнять палец и, чуть наклонив, быстро внести отверстие пробирки в пламя горелки. Следующую пробу проводят со второй пробиркой. * Почему? Проверку проводят до тех пор, пока проба водорода не будет загораться почти без звука.
Сбор водорода и его проверка на чистоту:
Только убедившись в чистоте выделяющегося водорода, можно поджечь его на выходе из прибора или начать нагревание прибора.
♣ Сборка прибора
Планирование. Готовясь собирать прибор, продумайте, какие узлы Вам понадобятся. Например: узел получения хлора; реакционная трубка; узел осушки и т. п. Прибор должен занимать как можно меньше места. Постарайтесь закрепить все детали на одном штативе, вот как здесь:
Нерационально сначала собирать прибор, а потом разбирать его, чтобы поместить внутрь реагенты. Если нет причин делать иначе, помещайте вещества сразу в нужное место.
Соединение узлов. Резиновые шланги и пробки, применяемые для соединения узлов и изоляции, могут подвергаться воздействию агрессивных сред (хлор и т. п.). Старая резина может пропускать газы, особенно водород. Поэтому надо использовать минимальные отрезки резиновых шлангов и стараться соединять части прибора «стык в стык».
Края всех стеклянных трубок должны быть оплавлены. * Как это делается? Чтобы облегчить надевание тугого шланга на стеклянную трубку, смочите ее каплей воды или глицерина. * Всегда ли все равно, чем смачивать?
Резиновые пробки, как и шланги, присоединяют, не вдавливая, а вкручивая. Избегайте нажимать на тонкие части стеклянной посуды.
Соединения на шлифах. Шлифы – это притертые стеклянные соединения. Шлиф с внешней поверхности трубки называется керн, внутренний шлиф – муфта. Соединять их следует, вставляя керн в муфту круговым движением. Шлифы обязательно надо смазывать. При работе с пониженным давлением пользуются вакуумной смазкой. Не нужно наносить много смазки: достаточно нанести тонкую полоску на керн; когда Вы соедините шлифы круговым движением, она размажется по всей поверхности. Перед соединением рекомендуется слегка обогреть шлифы горячим воздухом над горелкой.
Шлифы могут быть не только коническими. * Какие еще виды шлифов Вы встречали в лаборатории?
При работе с агрессивными газами или легколетучими жидкостями при атмосферном давлении в качестве смазки применяют фосфорную кислоту, при работе с неагрессивными соединениями без нагревания – вазелиновое масло или глицерин.
Закрепление прибора на штативах. Между металлической лапкой и стеклянной посудой, закрепляемой в штативе, надо поместить резиновую или термостойкую прокладку. * В каких случаях резиновая прокладка не годится? Сначала лапку с посудой зажимают рукой – плотно, но без усилия; потом закручивают винт лапки.
Обязательно должны быть закреплены колбы, реакционные трубки. Пример закрепления прибора:
Нет смысла располагать прибор четко «слева направо» и «строго по прямой». Расположение следует согласовывать с соседями (не помещать узел охлаждения рядом с горелкой соседа и т. п.). Чтобы прибор был компактен и занимал один штатив, изогните соединяющие резиновые трубки или используйте изогнутые стеклянные трубки (если это возможно).
Проверка на герметичность. Если пузырьки газа проходят через две промывалки с разной скоростью или не проходят совсем, это говорит о негерметичности прибора. Необходимо проверить соединения и пробки заново!
Когда промывалок в реакционном приборе нет, нужно закрыть выход прибора. Если прибор герметичен, то жидкость, находящаяся в колбе Вюрца, начнет быстро подниматься по воронке с длинной трубкой. Если же нет, можно найти место утечки, поочередно зажимая соединения частей прибора.
Проверка на герметичность:
Проверка на герметичность обязательна при работе с водородом и СО!
Занятие 2.
Демонстрационный эксперимент
♥ Опыты
1. Получение водорода действием металла на кислоту и изучение свойств водорода
В пробирку или небольшую колбу Вюрца поместить гранулы цинка.
Прилить через воронку с длинной трубкой 20% раствор H2SO4 (* почему именно такая концентрация?) и пропустить выделяющийся газ через реакционную трубку из тугоплавкого стекла с 0,5 г оксида металла (например, меди (II)).
Помещение оксида металла в реакционную трубку:
Выходное отверстие реакционной трубки должно быть закрыто согнутой стеклянной трубочкой, сужающейся на конце, для отвода непрореагировавшего водорода (рис. 11). В эту трубочку необходимо поместить медную спираль. * Зачем?
Рис. 11. Газоотводная трубка
Внешний вид прибора:
Прилить через воронку с длинной трубкой несколько капель раствора CuSO4. * Что изменилось и почему?
Проверить прибор на герметичность. * Как это сделать? Добиться герметичности подгонкой соединений или заменой узлов.
Проверить водород на чистоту. * Почему вначале выходящий из трубки водород не является чистым? Дождавшись, когда водород станет чистым, поджечь его на выходе.
Поместить над пламенем водорода холодную стеклянную воронку. * Объяснить наблюдения.
Прогреть реакционную трубку горелкой по всей длине, затем сильно нагреть ту часть трубки, где лежит оксид металла. Фото В.В. Загорского:
Если пламя погаснет (* почему это может произойти?), прекратить нагревание. Вновь поджечь водород можно после новой проверки на чистоту.
Если на стенках реакционной трубки оседает вода (* почему это может произойти?), удалить ее нагреванием.
Когда реакция закончится (* как это определить?), охладить прибор в токе водорода. * Почему нельзя сразу разбирать прибор?
** Оксиды каких металлов можно восстановить водородом? Дайте общий ответ.
2. Получение водорода
А) Действие металла на щелочь
В пробирку поместить 1-2 гранулы алюминия и 1-2 мл 40% раствора NaOH. Если реакция вначале идет медленно (* почему?), подогреть пробирку горячей водой. * Объяснить динамику реакции. Почему скорость реакции со временем возрастает?
Б) Действие металла на воду
Заполнить пробирку объемом 10-15 мл до краев водой. Закрыть отверстие большим пальцем, опрокинуть пробирку в кристаллизатор с водой и в таком положении закрепить в лапке штатива. Взять пинцетом или щипцами кусочек кальция и быстро подвести его под пробирку.
Убедиться в том, что в пробирке собран водород. * Как это сделать?
В) Действие кремния на щелочь
Поместить в пробирку небольшой кусочек кремния и прилить 40% раствор NaOH. * Как ускорить эту реакцию?
** Какой процесс лежит в основе методов получения водорода в лаборатории?
3. Получение кислорода
Наполнить несколько (* сколько? – см. опыт 4) баночек кислородом из кислородной подушки. Для этого нужно налить в баночку до краев воду, закрыть стеклянной пластинкой, перевернуть и погрузить в кристаллизатор с водой. Опустить газоотводную трубку подушки в кристаллизатор и, открыв кран, отрегулировать скорость подачи кислорода (чтобы можно было легко считать пузырьки газа). Подвести газоотводную трубку под отверстие баночки. Когда баночка будет почти наполнена кислородом, закрыть ее под водой пластинкой и вынуть.
* Какими еще способами получают кислород в лаборатории?
** Какой процесс лежит в основе этих способов?
4. Изучение свойств кислорода
А) Поместить немного серы в железную ложечку, поджечь серу и внести ее в баночку с кислородом. После прекращения горения серы влить в баночку несколько капель индикатора (на фото справа). * Какие индикаторы можно использовать? * Как меняется характер горения веществ при внесении их в кислород? Почему?
Б) Скрутить в спираль железную проволоку, вставить в нее спичку. Взять проволоку щипцами, поджечь спичку и внести проволоку в баночку с кислородом. * Горит ли железо на воздухе? Если да, то какие для этого нужны условия?
** Какие химические свойства характерны для кислорода?
5. Свойства пероксида водорода
А) Налить в пробирку около 1 мл 10% раствора Н2О2. Всыпать немного порошка MnO2. * Какую роль играет MnO2? Доказать, что за газ выделяется. * Как это сделать?
Б) Реакции в кислой среде
Прилить раствор Н2О2 к 1 мл раствора KMnO4, подкисленного 1 М раствором H2SO4.
Прилить по каплям раствор KI к 1 мл раствора Н2О2, подкисленного 1 М раствором H2SO4 (на фото слева). Экстрагировать образовавшийся иод (на фото справа). * Как это сделать? Какой растворитель для этого требуется?
Редкий случай: достигнута стехиометрия, иод выпал в осадок:
В) Реакции в щелочной среде
К 1 мл раствора соли хрома (III) (фото 1) прилить 20% раствор NaOH до растворения (фото 3) выпадающего вначале осадка (фото 2). Затем добавить 1 мл 10% раствора Н2О2 (фото 4). При необходимости нагреть пробирку на водяной бане.
На фото 5 – в избытке пероксида образовалось перекисное соединение хрома (VI). На фото 6 — перекисное соединение при подкислении.
К 1 мл раствора Н2О2 добавить немного иодной воды и 1 М раствора аммиака.
** Какие химические свойства проявляет пероксид водорода?
♣ Методы сбора газов
* С какими методами сбора газов Вы познакомились?
Собирать газы вытеснением воздуха можно в двух вариантах (рис. 12). * Приведите примеры газов, которые собирают по первому и второму вариантам. Каким критерием Вы пользуетесь, определяя, как собирать газ?
Рис. 12. Сбор газа вытеснением воздуха