Занятие 5. Индивидуальная работа.
Синтезы соединений галогенов
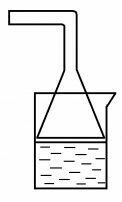
♣ 1: Насыщение раствора газом
Чтобы насытить хорошо растворимым в воде газом раствор, находящийся в стакане, нельзя опускать в раствор газоотводную трубку прибора для получения газа (* Почему?). Следует подобрать воронку, соответствующую внутреннему диаметру стакана, и присоединить ее к газоотводной трубке. Широкая часть воронки должна немного не доходить до раствора в стакане (рис. 16).
Рис. 16. Насыщение раствора хорошо растворимым газом
Если нужно насытить раствор газом, умеренно или плохо растворяющимся в воде, широкая часть воронки должна быть слегка погружена в раствор.
Если не предполагается выпадения осадка, можно использовать в качестве узла для насыщения газом промывалку.
♣ 2: Упаривание
Для упаривания раствор наливают в фарфоровую чашку и помещают на водяную баню. Водяная баня – металлический сосуд, закрывающийся сверху концентрическими плоскими кольцами (рис. 17). В баню заливают воду (2/3 объема), закрывают кольцами, ставят на треножник и нагревают до кипения пламенем горелки. Чашку с раствором ставят на баню, сняв нужное для устойчивого положения чашки число колец (так чтобы она была на 2/3 погружена в баню). Следите, чтобы в процессе упаривания из бани не выкипела вся вода!
Рис. 17. Водяная баня
Чтобы ускорить упаривание, можно удалять пары с поверхности жидкости, обдувая воздухом из подведенного сбоку шланга.
♣ 3: Запаивание вещества в ампулу
* Какие вещества предпочтительнее хранить в запаянных ампулах? Какие вещества нельзя хранить в запаянных ампулах?
Изготовление «полуфабриката» ампулы. На паяльной горелке прогреть среднюю часть пробирки, держа пробирку горизонтально за оба конца и непрерывно вращая ее пальцами в одном направлении. Когда стекло размягчится и начнет гнуться, вынуть пробирку из пламени и, осторожно вращая, медленно растянуть так, чтобы получился тонкий «перешеек».
Помещение вещества в ампулу. Охладить «полуфабрикат» до комнатной температуры. Аккуратно всыпать или влить вещество через «перешеек», используя воронку.
Запаивание ампулы. Внести «перешеек» в пламя паяльной горелки так, чтобы часть ампулы, где находится вещество, оставалась вне пламени. Нагревать при вращении, пока стекло не размягчится. Когда «перешеек» запаяется, отделить его верхнюю часть. Оттянутый конец ампулы нагревать еще некоторое время при вращении (в конце — в коптящем пламени).
♦ I. Галогены
Бром
Растворить 2 г дихромата калия в нагретом 25% растворе H2SO4 и добавить рассчитанное количество бромида калия. Перегнать бром из реакционной пробирки в мерную, сильнее всего нагревая среднюю часть реакционной пробирки. Мерную пробирку охлаждать.
Рассчитать массу брома и определить выход.
Использовать полученный бром для приготовления бромной воды.
Задания
1. Рассчитать необходимое количество (в граммах и миллилитрах) серной кислоты (чуть больше стехиометрии).
2. Рассчитать массу KBr.
3. В какой пробирке целесообразно проводить нагревание?
4. Как следует организовать стык двух пробирок – реакционной и мерной?
5. Почему нагревают среднюю часть пробирки, а не нижнюю и не верхнюю?
6. Чем охлаждать мерную пробирку?
7. Как рассчитать массу брома по его объему?
Иод
Отвесить по 0,5 г KI и MnO2, пересыпать в тигель и перемешать стеклянной палочкой. Поставить тигель на фарфоровый треугольник, прилить 3-4 капли конц. серной кислоты и быстро закрыть колбочкой, наполненной холодной водой. Колбочку закрепить в лапке штатива. Тигель слегка нагреть в течение нескольких минут.
Определить выход иода. Полученный иод использовать для демонстрации его свойств.
Иод под микроскопом:
Задания
1. Является ли соотношение реагентов стехиометрическим? Почему?
2. Для чего нужна колбочка, заполненная холодной водой?
3. Где собирается продукт реакции? На каком свойстве иода основан метод сбора?
♦ II. Галогениды
Хлорид железа (III)
К выходу узла для получения сухого хлора присоединить реторту (за горло), тубус которой заткнуть пробкой с длинной трубкой, направленной вертикально. В горло реторты поместить 0,5 г железа (проволоки или стружки, но не порошка!). Заполнить прибор хлором. Осторожно подогреть горло реторты, где лежит металл, затем, продолжая пропускать хлор, нагреть сильнее. При сильном раскаливании железа отставить горелку.
Реторту можно заменить трубкой из тугоплавкого стекла (см. получение хлорида алюминия).
По окончании реакции реторту охладить в токе хлора. Быстро отсоединить реторту и через горло удалить остаток непрореагировавшего железа с помощью магнита. Высыпать хлорид в предварительно взвешенную сухую пробирку, запаять и взвесить. Определить выход.
В реторту с остатками хлорида влить немного воды и каплю раствора нанести на индикаторную бумажку. Объяснить наблюдения. Экспериментально доказать чистоту продукта (отсутствие Fe2+).
Задания
1. Нарисуйте узел для получения сухого хлора.
2. Приведите не менее трех реакций получения хлора в лаборатории.
3. Почему нельзя нагревать железо, пока прибор не заполнен хлором?
4. Почему прибор нужно охлаждать в токе хлора?
5. Почему продукт надо хранить в запаянной ампуле?
6. Как доказать, какой из хлоридов железа образовался?
7. Как доказать отсутствие примеси другого хлорида железа в продукте?
8. Какую индикаторную бумагу целесообразно использовать?
Хлорид алюминия
В узкую трубку из тугоплавкого стекла насыпать свежую алюминиевую стружку так, чтобы она заполнила весь зазор трубки. Заполнить прибор сухим хлороводородом или хлором. Пропускать хлороводород или хлор, осторожно нагревая алюминий (не до плавления!). Собирать продукт в U-образную трубку.
Трубку из тугоплавкого стекла и U-образную трубку можно заменить ретортой (см. получение хлорида железа).
По окончании реакции прибор охладить в токе хлороводорода или хлора. Продукт быстро поместить в предварительно взвешенную сухую пробирку, запаять и взвесить. Определить выход.
В трубку с остатками хлорида влить немного воды и каплю раствора нанести на индикаторную бумажку. Объяснить наблюдения.
Задания
1. Нарисуйте узел для получения сухого HCl.
2. Напишите реакцию получения HCl в этом узле.
3. Нарисуйте узел для получения сухого хлора.
4. Приведите не менее трех реакций получения хлора в лаборатории.
5. Почему нельзя нагревать алюминий, пока прибор не заполнен хлором или HCl?
6. Почему прибор нужно охлаждать в токе хлора или HCl?
7. Почему продукт надо хранить в запаянной ампуле?
8. Почему не рекомендуется нагревать алюминий до плавления?
9. Какую индикаторную бумагу целесообразно использовать?
Хлорид олова (IV)
В пробирку Вюрца поместить гранулы олова (около 1 г), на выходе присоединить другую пробирку Вюрца. Изолировать выход прибора хлоркальциевой трубкой с CaCl2. Заполнить прибор сухим хлором. Пропускать сильный ток хлора, нагревая пробирку с оловом. Пробирку-приемник охлаждать.
По окончании реакции прибор охладить в токе хлора. Продукт поместить в предварительно взвешенную сухую пробирку, запаять и взвесить. Определить выход.
Продукт с растворенным в нем хлором:
В пробирку Вюрца с остатками продукта влить немного воды, изучить продукты гидролиза. Доказать, какой из хлоридов олова образовался.
Задания
1. Нарисуйте узел для получения сухого хлора.
2. Приведите не менее трех реакций получения хлора в лаборатории.
3. Почему нельзя нагревать олово, пока прибор не заполнен хлором?
4. Почему прибор нужно охлаждать в токе хлора?
5. Почему продукт надо хранить в запаянной ампуле?
6. Как различаются условия получения дихлорида и тетрахлорида олова?
7. Как доказать, какой из хлоридов олова образовался?
8. Как доказать отсутствие примеси другого хлорида олова в продукте?
Иодиды олова (IV) и (II)
А) В пробирку Вюрца поместить гранулы олова (около 1 г) и раствор иода в CCl4. Изолировать выход хлоркальциевой трубкой с CaCl2. Слегка нагреть пробирку.
По окончании реакции слить раствор с непрореагировавшего олова, вылить в чашку Петри или накапать на предметное стекло и оставить под тягой до полного испарения растворителя.
Испарение растворителя:
Продукт в чашке и под микроскопом:

 (фото справа предоставлено А.И.Жировым)
(фото справа предоставлено А.И.Жировым)
Б) В пробирке или колбе к 20% раствору соляной кислоты добавить немного иодида калия и кусочки оловянной фольги. Прибавить небольшое количество иода и нагреть до кипения. Иод добавлять по мере расходования.
По окончании реакции слить раствор с непрореагировавшего олова, вылить в чашку Петри или накапать на предметное стекло и оставить под тягой до полного испарения растворителя.
Продукт:
Задания
1. Почему выход пробирки Вюрца (п. А) изолируют от воздуха?
2. Почему раствор в чашке Петри или на предметном стекле помещают под тягу?
3. Как различаются условия получения дииодида и тетраиодида олова?
4. Как доказать, какой из иодидов олова образовался?
5. Как доказать отсутствие примеси другого иодида олова в продукте?
Трихлорид иода
Поместить раствор иода в ССl4 в пробирку Вюрца, выход которой изолирован хлоркальциевой трубкой с CaCl2. Умеренно нагреть пробирку Вюрца. Прекратив нагревание, пропускать в пробирку Вюрца сухой хлор до полного окончания реакции. Трубка для пропускания газа должна быть при этом погружена в раствор. Осадок отфильтровать на воронке со стеклянным фильтрующим дном. Сразу поместить продукт во взвешенный бюкс или пробирку с пробкой, немедленно закрыть, взвесить, рассчитать выход.
Часть продукта растворить в воде и в щелочи.
Задания
1. Нарисуйте узел для получения сухого хлора.
2. Приведите не менее трех реакций получения хлора в лаборатории.
3. Как определить момент окончания реакции?
4. Почему продукт сразу переносят в бюкс или пробирку?
5. Почему продукт не запаивают в ампулу?
6. Как отличаются условия получения трихлорида иода и монохлорида иода?
7. Как отличить друг от друга трихлорид иода и монохлорид иода?
8. Что образуется при растворении трихлорида иода в воде? А в щелочи? Как это доказать?
Иодид свинца
В горячий раствор 2,2 г KI в 5 мл воды влить тонкой струей при перемешивании раствор нитрата свинца (II) (2,5 г в 5 мл воды). Осадок несколько раз промыть водой, используя декантацию.
Перекристаллизовать из горячей воды, подкисленной уксусной кислотой, при медленном охлаждении. Осадок отфильтровать на воронке Бюхнера, определить выход.
Задания
1. Рассчитайте молярные концентрации исходных растворов. Какова концентрация раствора иодида свинца в момент его получения? Сравните с растворимостью (0,068 г / 100 г воды при 20 оС).
2. Что такое декантация? Как ее осуществить?
3. Какой вид имеет осадок, полученный при перекристаллизации из горячей воды, при быстром охлаждении? При медленном? Объясните.
4. Чем отличается вид осадков иодида свинца, выпадающих из подкисленного и неподкисленного растворов? Зачем раствор для перекристаллизации подкисляют?
♦ III. Галогенаты калия
Хлорат калия (способ 1)
Налить в стакан 20 мл 50 % свежеприготовленного раствора КОН. Насытить раствор хлором. Отфильтровать кристаллы на воронке со стеклянным фильтрующим дном.
Перекристаллизация. Взвесить полупродукт. Растворить его в кипящей воде. Профильтровать на воронке для горячего фильтрования в стакан с холодной водой, достаточной для растворения KCl, находящегося в горячем маточном растворе. Охладить фильтрат до комнатной температуры. Выпавшие кристаллы отфильтровать, высушить и определить выход.
Проверить чистоту продукта от ионов натрия и от хлорид-ионов.
Задания
1. Нарисуйте узел для получения хлора.
2. Приведите не менее трех реакций получения хлора в лаборатории.
3. Нарисуйте узел для насыщения раствора хлором.
4. Рассчитайте, сколько КОН требуется для получения раствора.
5. Почему выпавшие кристаллы необходимо фильтровать именно на воронке со стеклянным фильтрующим дном?
6. Рассчитать массу хлората калия и хлорида калия в полупродукте.
7. Сколько нужно кипящей воды для растворения хлората калия? Растворимость при 90 оС 47,7 г/100 г воды.
8. Сколько хлорида калия растворится в кипящей воде вместе с хлоратом калия? Растворимость хлорида калия при 90 оС 54 г/100 г воды. Растворимость одной соли считать независимой от растворимости другой.
9. Сколько воды комнатной температуры необходимо для растворения этого количества KCl? Растворимость при 20 оС 34 г/100 г воды.
10. Рассчитать теоретический выход продукта, если растворимость хлората калия при 20 оС 7,4 г/100 г воды.
11. Как проверить чистоту продукта от ионов натрия и хлорид-ионов?
12. Откуда в продукт могут попасть ионы натрия? Почему важно, чтобы они не содержались в продукте?
Хлорат калия (способ 2)
Налить в стакан 20 мл раствора карбонатов натрия и калия в мольном отношении 5 : 1. Насытить раствор хлором при нагревании. Охладить до комнатной температуры, отфильтровать кристаллы на воронке со стеклянным фильтрующим дном.
Проверить чистоту продукта от ионов натрия и от хлорид-ионов. Если нужно, провести перекристаллизацию, как в способе 1. Определить выход.
Задания
1. Нарисуйте узел для получения хлора.
2. Приведите не менее трех реакций получения хлора в лаборатории.
3. Нарисуйте узел для насыщения раствора хлором.
4. Рассчитайте, сколько Na2CO3 и K2CO3 требуется для получения раствора, содержащего максимальное количество реагентов. Растворимость Na2CO3 при 60 оС 46,4 г/100 г воды, K2CO3 45,5 г/100 г воды.
5. Почему Na2CO3 и K2CO3 берутся в отношении 5:1?
6. Сколько NaCl должно получиться? Сколько граммов NaCl выпадет в осадок вместе с хлоратом калия? (растворимость NaCl при 60 оС 37,3 г/100 г воды, при 20оС 36,0 г/100 г воды)?
7. Рассчитайте теоретический выход продукта, если растворимость хлората калия при 20 оС 7,4 г/100 г воды. Растворимость одной соли считать независимой от растворимости другой.
8. Как проверить чистоту продукта от ионов натрия и хлорид-ионов?
9. Откуда в продукт могут попасть ионы натрия? Почему важно, чтобы они не содержались в продукте?
Бромат калия
В 35 мл воды растворить 2,4 г бромида калия и небольшой избыток КОН (по сравнению с рассчитанным количеством). Насытить раствор хлором (следить, чтобы отверстие газоотводной трубки не забивалось!).
Раствор охладить до 0 оС, выпавшие кристаллы отфильтровать на воронке со стеклянным фильтрующим дном и высушить на воздухе. Определить выход.
Задания
1. Рассчитайте необходимую массу КОН.
2. Нарисуйте узел для получения хлора.
3. Напишите 2-3 реакции получения хлора в лаборатории.
4. Нарисуйте узел для насыщения раствора хлором.
5. Рассчитайте теоретический выход продукта, если растворимость бромата калия при 0 оС 3,1 г/100 г воды. Растворимость соли считать независимой от растворимости других соединений.
6. Растворимость KCl при 0 оС составляет 27,6 г/100 г воды. Требуется ли перекристаллизация? Если да, опишите методику перекристаллизации.
Иодат калия
Тонко растертый порошок KMnO4 присыпать к горячему (80 оС) раствору 3 г KI в 20 мл воды. Прокипятить, профильтровать через воронку для горячего фильтрования и охладить фильтрат до 0 оС. Выпавшие кристаллы отфильтровать, высушить и определить выход.
Задания
1. Рассчитайте необходимое количество перманганата калия.
2. Зачем раствор фильтруют на воронке для горячего фильтрования?
3. Рассчитайте теоретический выход, если растворимость иодата калия при 0 оС 4,6 г/100 г воды. Растворимость соли считать независимой от растворимости других соединений.
♦ IV. Галогенидные комплексы
Гексахлороманганат (IV) калия
Растереть 5 г КMnO4 и внести при перемешивании в 50 мл конц. соляной кислоты, охлажденной смесью льда и поваренной соли (в отношении 3 : 1 по массе). Если необходимо, в реакционную смесь добавить KCl. Осадок быстро отфильтровать на воронке Бюхнера (использовать фильтр с мелкими порами) и высушить короткое время над СаО. Взвесить, рассчитать выход.
Часть продукта растворить в воде. Доказать, что находится в растворе.
Задания
1. В каком сосуде следует провести реакцию?
2. Рассчитайте, нужно ли дополнительное количество KCl; если да, то сколько?
3. Что образуется при растворении K2[MnCl6] в воде? Как это можно доказать?
Получение тетрахлороиодата (III) калия (способ 1)
К иодиду калия добавить смесь концентрированных растворов азотной и соляной кислот. Смесь нагреть до полного растворения продуктов реакции.
После охлаждения раствора отфильтровать выпавшие кристаллы на воронке со стеклянным фильтрующим дном.
Часть кристаллов растворить в воде. Доказать присутствие образовавшихся продуктов.
Задания
1. В каком сосуде следует провести реакцию?
2. Рассчитайте, сколько реагентов необходимо на 2 г иодида калия.
3. Чем может быть загрязнен продукт? Как доказать присутствие или отсутствие примесей?
4. Что образуется при растворении продукта в воде? Как это доказать?
Получение тетрахлороиодата (III) калия (способ 2)
В реакционную пробирку или стакан поместить раствор 3 г иодида калия в 7 мл воды и 1-2 мл концентрированной соляной кислоты. Пропустить через раствор сильный ток хлора. Хлорирование продолжать до тех пор, пока весь выпавший первоначально иод не прореагирует с хлором. При необходимости перемешать осадок иода на дне пробирки (стакана) стеклянной палочкой. Охладить раствор в бане со льдом. Выпавшие кристаллы отделить с помощью воронки со стеклянным фильтрующим дном. Высушить вещество в эксикаторе над серной кислотой.
Часть кристаллов растворить в воде. Доказать присутствие образовавшихся продуктов.
Задания
1. В какой пробирке целесообразно провести реакцию?
2. Чем может быть загрязнен продукт? Как доказать присутствие или отсутствие примесей?
3. Что образуется при растворении продукта в воде? Как это доказать?