♠ Техника безопасности
Опыты с галогенами следует проводить под тягой (в вытяжном шкафу). Необходимо работать в очках или маске. Все работы с галогенами, особенно бромом, можно проводить только с разрешения преподавателя.
Хлор – ядовитый зеленовато-желтый газ. Вдыхание небольших количеств его вызывает кашель, при вдыхании больших количеств возможны тяжелые последствия, в том числе воспаление и отек легких.
При тяжелом отравлении хлором до прибытия врача необходим покой, вдыхание кислорода. Пострадавшему дают молоко, согревают конечности. При несильном отравлении дают молоко, выводят на свежий воздух до исчезновения симптомов отравления.
Остатки MnO2 или KMnO4 (после получения хлора) выливайте не в раковину, а в «банки для слива» (под тягой). После того как основная масса из колбы перенесена в «банку для слива», следует заполнить колбу водой доверху, затем вылить эту воду в раковину под тягой. Лишь после этого можно вынести колбу из-под тяги.
Бром – тяжелая жидкость, образующая темно-красные пары, способные вызвать отравление, слезотечение, удушье и поражение дыхательных путей. На коже образуются трудно заживающие язвы. Наливать бром в пробирки и капельные воронки следует осторожно, через химическую воронку, только в резиновых перчатках.
При попадании брома на кожу следует быстро промыть пораженные места спиртом, большим количеством воды, а затем многократно 2% раствором гидрокарбоната натрия NaHCO3. При случайном вдыхании паров брома необходим покой, вдыхание паров разбавленного раствора аммиака, затем вдыхание кислорода.
Пары иода темно-фиолетового цвета, имеющие неприятный запах, похожий на запах хлора, разъедают слизистые оболочки. При отравлении парами иода следует вдыхать водяные пары с примесью аммиака, глаза промыть 1% раствором тиосульфата натрия Na2S2O3.
Занятия 3-4. Демонстрационный эксперимент
♣ 1: Очистка газов
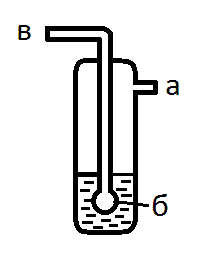
Если в узле для получения газа используется соляная кислота, сразу после него ставят промывалку с водой. * Зачем? Воду заливают через отвод а (рис. 13) так, чтобы она закрыла шарик б (или, при отсутствии шарика, была на 0,5 см выше дырочек). Трубку в присоединяют к узлу для получения газа.
Рис. 13. Осушитель в промывалке
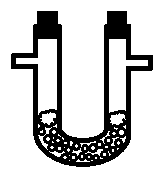
Осушка. Жидкий осушитель помещают в промывалку, твердый – в U-образную трубку. Насыпать твердый осушитель надо так, чтобы нижняя часть трубки была целиком им заполнена, а отводы – свободны (рис. 14); с обеих сторон осушитель ограничивается кусочками ваты. Жидкий осушитель заливают в промывалку при помощи специальной воронки с оттянутым концом (воронка Мюнке).
Рис. 14. Осушитель в U-образной трубке
Воздух, хлор, хлороводород обычно осушают конц. H2SO4 или безводным CaCl2. Сероводород и углекислый газ – безводным CaCl2. Сернистый газ – конц. H2SO4. Аммиак сушат твердыми щелочами или оксидами кальция, бария. Для осушки NO, NO2 используют P2O5, нанесенный на стекловату.
* Почему сероводород не осушают серной кислотой? Почему аммиак не осушают серной кислотой? Почему NO2 не осушают щелочами? Чем осушают водород?
Защита от аэрозолей. При получении газа в колбе или пробирке Вюрца прикапыванием жидкости к порошкообразному веществу легко образуются микроскопические твердые частицы или капельки, проносимые потоком газа через весь прибор – аэрозоли. Чтобы избежать загрязнения ими, вставьте в отвод колбы Вюрца (или на входе в промывалку, U-образную трубку) кусочек ваты.
♣ 2: «Фонтан»
Опыт «фонтан» проделывают с сухими газами, хорошо растворимыми в воде. Его можно использовать как одно из доказательств получения данного газа.
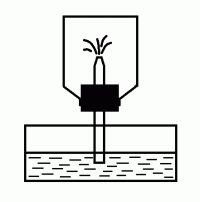
Выделяющимся газом наполняют сухую толстостенную банку, закрывают ее пробкой с трубкой, обращенной оттянутым концом внутрь (рис. 15). Открытый конец трубки помещают в кристаллизатор с водой (можно подкрасить воду индикатором). Закрывают трубку пальцем и встряхивают банку так, чтобы внутрь попала капля воды. Затем снова помещают трубку в воду и убирают палец. * Чем объясняется «фонтанирование» воды внутрь банки?
Рис. 15. Опыт «фонтан»
♥ Опыты
1. Получение хлора и хлорной воды
В колбу или пробирку Вюрца насыпать растертый в ступке и слегка смоченный водой (* для чего?) KMnO4, а через капельную воронку налить конц. HCl. Пропустить выделяющийся хлор через промывалку с дистиллированной водой (* для чего?) и через осушитель (* какой и в каком узле?).
* Как доказать, что выделяется хлор?
Пропустить хлор в пробирку с водой, охлаждаемой снегом.
Поднести к выделяющемуся хлору фильтровальную бумагу, смоченную раствором KI. Фиксировать происходящие изменения.
Наполнить хлором несколько банок (* сколько? – см. опыт 2) и закрыть их стеклянными пластинками. * Как определить окончание заполнения банки?
После окончания выделения хлора проверить, что находится в колбе Вюрца. * Как это сделать?
* Какими еще способами можно получить хлор в лаборатории?
** Какой процесс лежит в основе этих способов получения хлора?
2. Свойства хлора и хлорной воды
А) Поместить на листок бумаги немного порошка сурьмы и медленно высыпать ее в банку с хлором.
Фото В.В. Загорского:
Б) Поместить на листок бумаги немного порошка алюминия и медленно высыпать его в банку с хлором.
В) Положить в ложечку для сжигания немного красного фосфора, поджечь его и внести в банку с хлором. * Чем отличается характер и продукты горения фосфора на воздухе и в хлоре?
Г) 1 каплей хлорной воды (* где она образовалась? – см. опыт 1) смочить лакмусовую бумажку. * Каков состав хлорной воды?
** Какие химические свойства характерны для хлора? Какие химические свойства проявляет хлорная вода? А какие свойства проявляет хлор при образовании хлорной воды?
3. Свойства брома и бромной воды
А) Налить в термостойкую пробирку немного брома, закрепить ее вертикально в лапке штатива над песчаной баней и бросить в пробирку несколько зачищенных наждачной бумагой кусочков алюминия. * Сразу или нет начинается реакция? Почему?
Б) Поместить в пробирку немного сухого красного фосфора. Капнуть с помощью пипетки 1-2 капли жидкого брома. * Как отличается состав продуктов по высоте пробирки?
В) Капнуть 1 каплю жидкого брома в пробирку с водой.
Отлить 2-3 мл полученного раствора в другую пробирку и добавить по каплям 1 М раствор NaOH. Добавить к полученному раствору несколько капель 1 М раствора H2SO4. * Каков состав бромной воды? Какое влияние оказывают щелочь и кислота на смещение равновесия в бромной воде и почему?
** Какие химические свойства характерны для брома? Сравните взаимодействие алюминия и фосфора с хлором и бромом. Объясните различие.
4. Плавление и сублимация иода
А) Поместить несколько кристалликов иода в широкий стакан. Закрыть часовым стеклом. Осторожно нагреть.
Б) Насыпать в узкую пробирку иод (слой 1,5-2 см в высоту), заткнуть кусочком ваты. Нагреть горелкой дно пробирки, покачать и, наклонив, дать остыть.
** Чем обусловлено различие протекающих процессов в опытах А и Б?
5. Растворимость галогенов
А) Налить в пробирки по 2-3 мл хлорной, бромной и иодной воды (* какова растворимость галогенов в воде?) и прилить около 0,5 мл неполярного растворителя (* приведите 2 примера таковых). Закрыть пробирки пробками, встряхнуть, дать отстояться. * Вспомните, что такое экстракция.
Б) По одному кристаллику иода растворить в 1 мл CCl4, гексана, бензола, этилового спирта. * Объясните различие в окраске растворов. Иод в спирте, гексане, бензоле:
В) По одному кристаллику иода растворить в 1 мл растворов KI, KBr, KCl. * За счет чего происходит растворение иода в этих растворах? Иод в растворе KCl, KBr, KI:
** В каких растворителях лучше растворяются галогены – полярных или неполярных, – и почему?
6. Сравнение окислительных свойств галогенов
В пробирку с раствором KBr прилить 0,5 мл неполярного растворителя (* зачем?) и постепенно, при взбалтывании, добавлять хлорную воду из опыта 1. Повторить с раствором KI.
Cl2 + избыток KI:
Сl2 + мало KI (иод на стенках):
В пробирку с раствором KCl постепенно добавлять бромную воду.
** Как изменяются окислительные свойства галогенов в группе?
7. Взаимодействие галогенидов с концентрированной серной кислотой
В одну пробирку поместить немного сухого KCl, в другую – KBr, в третью – KI. Смочить соли 1-2 каплями конц. серной кислоты. К отверстию каждой пробирки поднести поочередно лакмусовой бумажку; бумажку, смоченную раствором KMnO4; и бумажку, смоченную раствором нитрата или ацетата свинца. * Для чего?
** Какие свойства галогенидов можно сравнить на основании этого опыта?
8. Получение и свойства хлороводорода
А) В колбу Вюрца насыпать 5-10 г NaCl так, чтобы поверхность соли была скошена (* зачем?). На выходе поставить U-образную трубку. * Какой осушитель в нее поместить? Через капельную воронку прилить в колбу конц. H2SO4. Осторожно нагреть колбу через асбестовую сетку. Наполнить хлороводородом сухую толстостенную банку. * Как это сделать? Как определить окончание ее заполнения?
Б) Проделать опыт «фонтан». * Какими индикаторами можно подкрасить воду – лакмусом, метилоранжем, фенолфталеином?
** О каких свойствах хлороводорода говорит опыт Б? Можно ли использовать опыт А для получения бромоводорода, иодоводорода?
9. Качественные реакции на галогенид-ионы
А) Подействовать на растворы хлорида, бромида и иодида калия раствором нитрата серебра. Проверить растворимость осадков в 1 М растворе аммиака.
Б) Подействовать на растворы хлорида, бромида и иодида калия раствором нитрата или ацетата свинца.
** Как различить хлорид и бромид? Бромид и иодид?