Майоров Роман, выпуск 1995 года (Майоров Роман занял 1 место но международной конференции школьников в г.Черновцы в мае 1995 г.)
Это получилось случайно. Во время поездки в замечательный город Владимир мы с Сергеем Николаевичем Сергеевым разговорились на тему «Физика и химия. Что из них важнее?». Я, как ученик химкласса (между прочим, сейчас я учусь на физфаке),естественно, цитировал фразу Вячеслава Викторовича Загорского «Все науки- частный случай химии, а химия- частный случай пиротехники». Сергей Николаевич выразил некоторые сомнения по этому поводу и рассказал мне о так называемой реакции Белоусова-Жаботинского. предложив мне определить. к какому предмету это относится: к физике шли химии. С одной стороны, это химическая реакция, но с другой стороны, это колебательный процесс, т.е. чистая физика. Тут я призадумался и решил попробовать провести эту реакцию сам. и узнать про нее как можно больше. В первую очередь, конечно, я обратился к В.В.Загорскому, и он мне дал «рецепт» этой реакции, но рассказывать о ней ничего не стал, пообещав, правда, помочь с реактивами. Вскоре я достиг все необходимые компоненты и провел эту реакцию. Она меня просто потрясла. Периодическое самопроизвольное изменение цвета раствора в течение некоторого времени показалась мне чудом. Естественно, что мне захотелось узнать механизм этой реакции. С.Н.Сергеев посоветовал мне покопаться в библиотеке МГУ. Потратив некоторое время, я нашел несколько книжек на эту тему. Но там было написано, что точный механизм этой реакции неизвестен, но удалось выделить некоторые стадии. Мое любопытство не было удовлетворено, и я уже всерьез заинтересовался этой реакцией. Пришлось по крупицам собирать все, что известно на эту тему, даже пришлось переводить с английского одну статью. Так это началось, а к чему это привело- это уже суть моей работы 1
Реакция Белоусова-Жаботинского.
Данная работа затрагивает один из наиболее известных колебательных процессов — реакцию Белоусопа-Жаботинского. Эта реакция была открыта в 1958 году отечественным химиком Б.П. Белоусовым. Реакция протекала в водном растворе при избыточном содержании протонов, т.е. в кислой среде, в присутствии ионов Ce3+ которые играли двойственную роль, будучи катализатором, не расходующимся в реакции, и окрашенным индикатором реакции. Гомогенный раствор с большой точностью стал периодически изменять окраску с бледно-желтой на желтую.
В реакционной смеси находятся ионы церия двух типов: ионы+4 имеют еле заметную бледно-желтую окраску, в то время как ионы +3 интенсивно окрашены в желтый цвет В зависимости от соотношения концентраций [+4]/[+3] во времени наблюдается правильный ритм в смене окраски из желтой в бесцветную и наоборот, что наглядно подтверждает возможность колебательного поведения реакции.
Правда, тут надо отметить, что периодичность наблюдается только в том случае.если точно соблюдена пропись реакции, иначе колебания становятся хаотическими. Несколькими годами позже Жаботинский повторил и подтвердил опыты Белоусова, заменив лимонную кислоту на малоновую. В ходе дальнейших исследований сульфат церия был заменен на сульфат железа, который также может менять степень окисления. В этом случае необходим органический краситель, например фенантролин C12H8N2*H20 , и будет происходить смена красного цвета на синий и наоборот , в зависимости от соотношений концентраций [Fe2+]/[Fe3+] во времени.
Качественный состав , демонстрируемой мною при докладе смеси :
CH2(COOH)2-KBrO3-FeSO4*7H2O-C12H8N2*H2O-H2SO4-H2O.
Наличие таких пространственных областей в первоначально однородной жидкости говорит об установлении порядка , т.е. явлении самоорганизации. Также, очевидно, что реакции протекаю! вдали от состояния равновесия, что, является непременным условием протекания биохимических процессов во всех живых организмах. Необычайная сложность жизненных процессов, по всей видимости, складывается из наложения многих тысяч взаимосвязанных химических реакций, многие из которых совершенно определенно протекают вдали от термодинамического равновесия Таким образом. если только одна сравнительно простая реакция может давать такое разнообразие «жизнеподобного» поведения, то обширная сеть реакций тем более может творить и поддерживать жизнь на нашей планете.
Так же, по моему мнению, реакции такого типа, в которых происходят явления самоорганизации, вполне вероятно, могли бы лежать в основе возникновения жизни из первичного бульона, они представляют особый интерес, но ,к сожалению, их кинетика до снх пор полностью неизвестна Поэтому у меня возникло желание рассмотреть их поведение как динамической системы
Первоначально такой способ рассмотрения динамических систем возник в Брюсселе под руководством лауреата Нобелевской премии И.Пригожина Модель, описанная ниже, была предложена Пригожиным и Лефевром в 1968 году в Брюсселе.и в честь этого названная брюсселятором. Брюсселятор представляет из себя модель, которая не описывает реальной реакции, но имеет колебательное решение
Л => X
В + X => Y + D
2Х + Y => ЗХ
X => Е
где А,В исходные продукты для «подкормки» системы,
X,Y — промежуточные продукты, описывающие поведение системы,
D,E — продукты «жизнедеятельности».
Предполагается, что все реакции необратимы, константы скорости равны единице, реакция протекает в жидкой или газовой фазе и в начальный момент времени вес компоненты реакции равномерно распределены по всему реактору, это дает основание отнести такую реакционную систему к типу пространственно-однородных систем, что, в свою очередь, позволит не учитывать процесса диффузии при математическом описании реакции.
Впервые такой подход к реальной реакции применили Филд, Нойсс и Кереш из штата Орегона, и модель, по традиции, была названа орегонатором
А + Y => X
X + Y => 2Р
А + X => 2Х + 2Z
2Х => А + Р
В + Z => Y
где A — BrO3 , У — Br-, X — HBrO2 P — HOBr, В — CHBr(COOH)2 , Z — Ce4+.
Эта модель соответствует следующим элементарным стадиям рассматриваемой реакции Белоусова-Жаботинского.
BrO3- + Br— + 2Н+ => НВrO2 + НОВr
Вr— + НВrO2 + Н+ => 2НОВг
2Се3+ + BrO3- + HВгО2, + ЗН+ => 2НВrO2 + 2Се4+ + Н2O
2HBr02 => HOBr + ВгО3 + Н+
4Сe4+ + BrCH(COOH)2 + 2Н20 => 4Се3+ + НСООН + 2СO2 + 5Н++Вr—
При расчетах предполагалось , что концентрации А,Р и В постоянны , a X,Y изменяются.
Если обозначить концентрации веществ теми же буквами, что и вещества, и положить, что все реакции необратимы , константы скорости равны единице , а система пространственно однородная , то ее поведение можно описать следующей системой нелинейных дифференциальных уравнений .
dX/dt = AY — XY + АХ — Х*Х ,
dY/dt = -AY — XY + BZ ,
dZ/dt = AX — BZ .
Равновесие наступает при dX/dt = dY/dt = dZ/dt. = 0 . Решая систему из трех уравнений найдем , что Хравновесное = А , Yравновесное = А/2 . Zравновесное = А*А/В .
Для исследования процесса перехода в равновесное состояние при малых отклонениях от концентрации равновесия мною было рассмотрено соответствующее характеристическое уравнение этой системы .
X = A + х
Y = А/2 + у
Z = А*А/В + z ,
где Х,у и Z — малые отклонения от концентрации равновесия . Подставляя эти значения X,Y и Z в систему из трех дифференциальных уравнений и получим , что
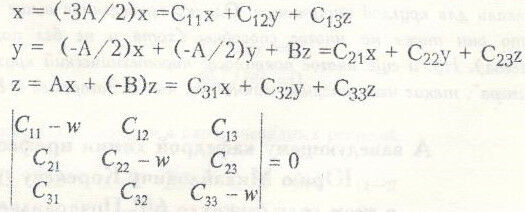
Это характеристическое уравнение дает три вещественных и отрицательных корня (w1 = -В , w2 — -2А , w3 = -ЗА/2), что соответствует на фазовой диаграмме особой точке типа » устойчивый узел » и не дает колебаний при подходе к положению равновесия . Проведенное мною численное моделирование на ЭВМ подтвердило аналитический результат — По оси абсцисс мною была отложена концентрация вещества Х(НВгO2) , а по оси ординат концентрация вещества Y(Br-) и получен устойчивый узел , т.е. , другими словами , система . выведенная из положения равновесия , снова стремится к нему и не дает колебаний .
Таким образом, модель орегонатор, будучи простейшей моделью реакции Белоусова-Жабогинского , не описывает колебательных движений при подходе к положению равновесия
Мною , однако , было замечено , с точки зрения химии вместо реакции :
2Се3+ + ВгО3- + ИВгO2 + ЗН+=> 2НВrO2 + 2Се4+ + Н20
возможна , и , более того , предпочтительна при избытке ВгОЗ- следующая реакция :
4Се3+ + 2ВrO3- + НВrO2 + 6H+ => ЗHВгO2 + 4Сe4+ + 2H20
В такой интерпретации модель реакции будет :
А + Y => X
X + Y => 2Р
2А + X => ЗХ + 4Z
2Х => А + Р
В + Z => Y
Проведенные мною , аналогичные вышеизложенным , численные исследования на ЭВМ дают колебательный процесс с особой точкой типа » устойчивый фокус «. По осям абсцисс и ординат мною были отложены концентрации веществ Х(НВгO2) и Y(Br—) соответственно , аналогично первому случаю .
Таким образом , измененная мною модель более точно описывает динамику поведения реакции Белоусова-Жаботинского при подходе к положению равновесия . ее ли судить по результатам проведенных мною исследований
Кафедра химии и химический класс были образованы в СУНЦ МГУ в 1989 учебном году. До этого многие поколения выпускников учили наизусть бессмертные фразы Марины Сергеевны Веденеевой: «Доменный процесс очень красив… Это тяжелое, но мудрое превращение бесформенного куска руды в чугун…» и ласково именовались ею на уроках «удавчики полосатые». Так что выпускники-спонсоры твердо убеждены, что химикам стипендия не полагается и единственное исключение сделали для круглой отличницы. Однако приведенная выше статья показывает. что они тоже на многое способны (хотя и не без поддержки физика С.Н.Сергеева). Ну, и еще многое появилось: пиротехнический кружок, летний лагерь «Химера», такие неординарные личности, как В.Загорский и Е. .Менделеева.
