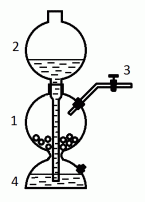
♣ Аппарат Киппа
Аппарат Киппа (рис. 20) предназначен для получения газов реакцией жидкости с твердым веществом. Его принципиальное отличие от колбы или пробирки Вюрца в том, что это прибор периодического действия (реакцию можно в любой момент остановить, а затем продолжить).
Рис. 20. Аппарат Киппа
Аппарат Киппа работает по принципу сообщающихся сосудов. Твердое вещество (* какие твердые вещества применяют для получения газов в аппарате Киппа?) помещается в шар 1.
Через шаровую воронку 2 с трубкой, доходящей почти до дна прибора, наливается кислота. * Какие кислоты используют?
При закрытом кране 3 лишь часть жидкости проходит в нижний полушар 4, сжимая находящийся там воздух, а часть остается в шаре воронки.
Когда кран 3 открывают, воздух выходит, и жидкость свободно выливается, заполняя нижний полушар и проникая в шар 1. Происходит контакт жидкости с твердым реагентом, выделяется газ, который устремляется наружу через газоотводную трубку с краном 3. Поток газа регулируется краном.
Когда кран 3 закрывают, газ продолжает выделяться еще некоторое время. Он заполняет шар 1 и вытесняет жидкость в нижний полушар 4 и воронку 2. Реакция останавливается.
Занятие 10. Демонстрационный эксперимент
На предыдущих занятиях Вы учились делать выводы из экспериментов согласно предложенным вопросам под двумя звездочками. Начиная с этого занятия, Вам предстоит делать выводы самостоятельно. Ставя какой-либо опыт, хорошенько подумайте, о чем он может Вам сказать, для чего Вы его проделываете.
♥ Опыты по теме «Углерод»
1. Свойства углерода
А) В сухой пробирке слегка нагреть несколько кристалликов нитрата свинца. * Что получается при их термическом разложении? Для чего оно проводится? Какие вещества, кроме нитрата свинца, можно было бы использовать для этого? Прекратить нагревание и внести в пробирку несколько кусочков угля. Закрыть пробкой и встряхнуть. * Как называется и за счет чего происходит наблюдающееся явление?
Б) Поместить в пробирку смесь 1 г CuO и 0,25 г угольного порошка, закрыть пробкой с газоотводной трубкой и опустить трубку в пробирку с раствором гидроксида кальция. * Для чего он нужен? Осторожно нагреть пробирку, затем сильно прокалить. Наблюдать происходящие изменения.
Б) К щавелевой кислоте в пробирке добавить концентрированную серную кислоту и нагреть. * Как определить состав выделяющегося газообразного продукта?
2. Оксид углерода (II) (опыт проводить под тягой!)
В небольшую колбочку налить 5 мл концентрированной муравьиной кислоты и 15 мл конц. серной кислоты, нагреть примерно до 60 оС. Пропустить выделяющийся газ через трубку с оксидом меди, затем через U-образную трубку с раствором гидроксида кальция (* для чего он нужен?), и поджечь на выходе. * Как это сделать? Какой узел должен стоять на выходе? Нагреть оксид меди.
3. Оксид углерода (IV)
А) Получить CO2 в аппарате Киппа. * Какие реагенты для этого потребуются?
Б) Наполнить большой стакан СО2 (* как это сделать?), опустить в него горящую лучину. Аккуратно перелить СО2 в маленький стакан, проверить его наличие с помощью горящей лучины.
В) Пропустить СО2 в пробирку с водой, подкрашенной лакмусом.
Г) Пропустить СО2 в раствор гидроксида кальция. После выпадения осадка продолжить пропускание газа до растворения осадка. * Какой еще газ ведет себя так же?
4. Оксалаты
А) Нагреть оксалат кальция или бария в пробирке. Определить состав продукта. * Как это сделать?
Б) Получить осадок оксалата меди. * Какие растворы надо взять для этого? Отфильтровать осадок, высушить и прокалить. Определить состав продукта. * Как это сделать?
5. Карбонаты
А) Определить рН свежеприготовленных растворов гидрокарбоната и карбоната натрия. * Как он отличается и почему? Приведите уравнения гидролиза, рассчитайте константы этих процессов.
Б) Нагреть в сухих пробирках примерно по 0,5 г твердых гидрокарбоната натрия, карбоната аммония и основного карбоната меди.
♥ Опыты по теме «Кремний»
1. Получение кремния (опыт проводить под тягой, в очках или маске, в присутствии преподавателя!)
В пробирку, закрепленную наклонно в лапке штатива над листом асбеста, поместить смесь чистого кварцевого песка с удвоенным объемом порошка магния (всего 0,2-0,3 г). Слабо нагреть пробирку пламенем горелки, потом сильно накалить ее дно.
По окончании реакции (* как установить, что она закончилась?) пробирку охладить и разбить. Полученную массу осторожно всыпать в стакан с 10 мл 20 % раствора HCl.
(последнее фото предоставлено В.В. Загорским)
Отфильтровать коричневое вещество.
2. Свойства кремния
А) Поместить в пробирку немного кремния и прилить конц. H2SO4. * В каких кислотах можно растворить кремний?
Б) Поместить в пробирку немного кремния, прилить 2-3 мл 20 % раствора NaOH и закрыть пробкой с газоотводной трубкой, оттянутой вверху. Нагреть пробирку в стакане с горячей водой. * Какой газ выделяется? Как это доказать? Что образуется в растворе? Как это доказать?
3. Силикаты
А) Определить рН раствора силиката натрия. * Чем объясняется его значение? Рассчитайте константу соответствующего процесса.
Б) Налить в пробирку небольшое количество раствора силиката натрия (силикатный клей). Пропустить в раствор углекислый газ. * Как его получить?
В) Налить в стаканчик объемом 50 мл раствор силиката натрия (клей) примерно до половины, чуть подкислить HCl и добавить по 2-3 кристаллика солей Ni (II), Cu (II), Mn (II), Cd (II), Fe (III). Оставить опыт до следующего занятия.