Занятие 7.
Индивидуальная работа.
Синтезы соединений серы
♣ 1: Перегонка
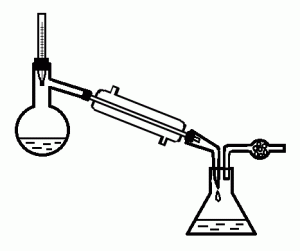
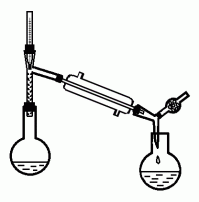
* Найдите на рис. 18: колбу для перегонки, термометр, аллонж, холодильник, приемник, хлоркальциевую трубку, дефлегматор. Для чего они нужны?
* Как должен быть направлен ток воды в холодильнике?
* Какой из приборов на рис. 18 следует применять для очистки жидкости от растворенных в ней твердых веществ? Для очистки жидкости от жидких примесей? Почему?
Не забывайте, что если вы разгоняете несколько жидкостей, то фракции (порции жидкости с разными температурами кипения) надо собирать в разные приемники.
Перегонка должна быть закончена, когда в перегонной колбе остается 2-3 мл жидкости.
Рис. 18. Приборы для перегонки
♣ 2: Нагревание и охлаждение колб
Приемы нагревания. Для равномерного распределения тепла при нагревании колб применяют асбестовые сетки, которые помещаются на кольцо, закрепленное в штативе. Между сеткой и колбой должен быть небольшой (несколько миллиметров) зазор. * Зачем?
Для осторожного нагревания до небольших температур используют водяные бани.
Если требуется высокая температура (200-300о С), применяют песчаную баню. Она представляет собой сковороду или железный противень с тонким слоем чистого сухого песка, который греют горелкой или плиткой. Дно колбы нужно аккуратно погрузить в песок.
Если в колбе находятся легковоспламеняющиеся вещества, рядом не должно быть открытого огня. В таких случаях нагревание проводят на электроплитке.
Приемы охлаждения. Для охлаждения колбы с помощью холодной воды воду наливают в водяную баню или кристаллизатор и погружают туда дно колбы.
Если применяется снег (а также лед или охлаждающие смеси), колба должна находиться в углублении в снегу, который должен закрывать не только дно, но и стенки колбы до верхней границы находящегося в ней вещества. Колба будет охлаждаться лучше, если снег (лед, охлаждающая смесь) смочены водой. * Почему?
Предназначенный для охлаждения лед следует колоть как можно мельче. Готовя охладительные смеси, тщательно перемешивайте компоненты. В практикуме можно использовать смеси на основе льда и солей:
NaCl (33 г / 100 г льда) → –21 оС
NaNO3 (59 г / 100 г льда) → –18 оС
NH4NO3 (45 г / 100 г льда) → –17 оС
CaCl2×6H2O (143 г / 100 г льда) → –40 оС
Температуры смесей даны для точного массового соотношения и идеального смешения компонентов; при приготовлении «на глазок» делайте поправку: скорее всего, температура смеси будет выше. Для контроля можно использовать термометр.
♦ I. Сульфиды
Аморфный сульфид сурьмы (III)
Растворить 7,5 г трихлорида сурьмы в минимальном количестве конц. HCl и осторожно, при перемешивании разбавить раствор водой до объема 150 мл.
Вот что может получиться, если разбавлять неаккуратно. Что это?
Полученный раствор нагреть до 40-50 оС и насытить его сероводородом. Осадок отфильтровать на воронке Бюхнера и высушить. Определить выход.
Задания
1. Нарисуйте узел для получения сероводорода.
2. Приведите реакцию получения сероводорода в этом узле.
3. Нарисуйте узел для насыщения раствора сероводородом.
4. Почему реакция идет, хотя соляная кислота сильнее сероводородной?
5. Почему трихлорид сурьмы растворяют не в воде, а в соляной кислоте?
6. Чем должны различаться условия получения кристаллического и аморфного сульфида сурьмы (III)?
Кристаллический сульфид кадмия
Растворить 5 г сульфата кадмия в избытке концентрированного NH3. На холоду добавить тиомочевину. Затем нагреть до кипения и кипятить 1-2 мин. Охладить до комнатной температуры, осадок отфильтровать. Если осадок не выпадает, снова прокипятить. Осадок высушить, определить выход.
Задания
1. Рассчитайте приблизительный объем раствора аммиака, требуемый для растворения.
2. Почему сульфат кадмия растворяют в растворе аммиака, но не в воде?
3. Рассчитайте необходимую массу тиомочевины.
4. Чем должны различаться условия получения кристаллического и аморфного сульфида кадмия?
Кристаллический сульфид свинца
Растворить 5 г нитрата свинца (II) в воде и осторожно прикапать полученный раствор к избытку 10 % раствора NaOH. На холоду добавить тиомочевину. Затем нагреть до кипения и кипятить 1-2 мин. Охладить до комнатной температуры, осадок отфильтровать. Если осадок не выпадает, снова прокипятить. Осадок высушить, определить выход.
Задания
1. Рассчитайте приблизительный объем раствора щелочи, требуемый для растворения.
2. Почему нитрат свинца растворяют в растворе щелочи, но не в воде?
3. Рассчитайте необходимую массу тиомочевины.
4. Чем должны различаться условия получения кристаллического и аморфного нитрата свинца?
♦ II. Соединения серы и хлора
Хлориды серы
Расплавить в реторте 1 г серы и, поворачивая реторту, покрыть внутренние стенки тонким слоем серы. Горло реторты опустить во взвешенную колбочку, охлаждаемую снегом; зазор между горлом реторты и горлом колбочки заткнуть ватой.
Слегка обогревая горелкой реторту, пропустить в тубус умеренный ток сухого хлора.
Закрыть колбочку-приемник взвешенной пробкой, взвесить, определить выход.
Влить немного полученной жидкости в воду.
Пробирку с полученной жидкостью поставить в стакан со льдом и пропустить через нее сильный ток сухого хлора.
Задания
1. Нарисуйте узел для получения сухого хлора.
2. Приведите минимум две реакции получения хлора в этом узле.
3. Почему зазор между горлом реторты и горлом колбочки нельзя закрыть наглухо?
4. Что представляет собой жидкость, собирающаяся в колбочке?
5. Что получается при ее растворении в воде?
6. Что получается при пропускании в эту жидкость сильного тока хлора?
Хлорид тионила
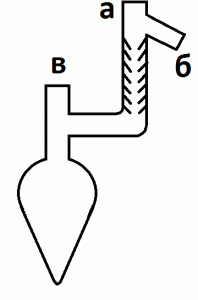
Cобрать прибор для перегонки, используя в качестве перегонной колбы колбу Кляйзена (рис. 19); в отверстие а вставить термометр, к отверстию б присоединить холодильник. Поместить в колбу 5 г пентахлорида фосфора. Включить холодильник. Приемник охлаждать снегом. Пропустить в отверстие в с помощью газоподводящей трубки ток тщательно высушенного сернистого газа.
Рис. 19. Колба Кляйзена
Если реакция замедлится, колбу слегка подогреть, осторожно встряхивая ее, пока весь PCl5 не прореагирует.
Нагревая колбу на плитке, собрать в приемник фракцию, кипящую при 80-85 оС. Определить выход.
Несколько капель продукта растворить в воде. Доказать, какие продукты получились.
Запаять продукт в ампулу.
Задания
1. Нарисуйте узел для получения сухого SO2.
2. Приведите не менее двух реакций получения SO2.
3. Почему SO2 должен быть сухим?
4. Нарисуйте прибор для перегонки.
5. Чем загрязнен получающийся хлорид тионила?
6. Что получается при растворении хлорида тионила в воде? Как это доказать экспериментально?
♦ III. Соединения с кислородсодержащими анионами серы
Серная кислота (нитрозный способ)
Большую колбу закрыть пробкой с тремя отверстиями (или использовать трехгорлую колбу). В одно из них вставить газоотводную трубку прибора для получения SO2 (из сульфита натрия и 70 % раствора серной кислоты), в другое – газоотводную трубку прибора для получения NO2 (из медных стружек и концентрированной азотной кислоты). В третье отверстие вставить стеклянную трубочку.
Приливать азотную кислоту к медным стружкам по каплям. Как только большая колба заполнится парами оксида азота (IV), начать прикапывать серную кислоту к сульфиту натрия.
С помощью резиновой груши прилить через стеклянную трубочку в колбу 2-3 мл воды и ополоснуть стенки.
Открыть пробку. Прилить еще 2-3 мл воды, вновь ополоснуть колбу и вылить жидкость в стакан. Доказать, что это раствор серной кислоты.
Задания
1. Нарисуйте узел для получения SO2.
2. Нарисуйте узел для получения NO2.
3. Как определить, что колба заполнена оксидом азота (IV)?
4. Что оседает на стенках большой колбы, когда в нее поступает SO2? Как при этом изменяется окраска газа в колбе и почему?
5. Как доказать, что получается раствор серной кислоты?
6. Какие примеси содержит нитрозная серная кислота, как определить их присутствие?
Тиосульфат натрия
Проверка сульфита натрия на чистоту: Растворить сульфит, налить равные объемы раствора в 2 пробирки. В каждую добавить избыток раствора хлорида бария, и в одну из них – конц. HCl. Сравнить объемы осадков и примерно оценить долю сульфита натрия в веществе.
Смочить спиртом двукратный (по отношению к сульфиту) избыток серы, перенести в 20 мл воды. Добавить немного препарата сульфита натрия и кипятить раствор. Препарат добавлять по частям по мере реакции, объем раствора поддерживать постоянным.
Горячий раствор отфильтровать и упарить на водяной бане наполовину. Охладить до 0 оС, помешивая стеклянной палочкой. Отфильтровать кристаллы на воронке Бюхнера. Определить выход. Доказать, что это тиосульфат.
Задания
1. Чем может быть загрязнен сульфит натрия?
2. Как будут соотноситься объемы осадков при проверке на чистоту, если сульфит загрязнен, и почему?
3. Оцените, сколько препарата сульфита натрия понадобится для реакции с учетом степени его чистоты, если чистого сульфита натрия требуется 4 г.
4. Рассчитайте требуемую массу серы.
5. Почему сера берется в избытке?
6. Для чего серу смачивают спиртом?
7. Как поддерживать объем раствора постоянным?
8. Почему сульфит натрия добавляют частями?
9. Как определить момент окончания реакции?
10. Для чего раствор после реакции фильтруют?
11. Почему при охлаждении раствор надо помешивать?
12. Как доказать экспериментально присутствие тиосульфата?
Дитионат бария
5 г растертого диоксида марганца размешать в 25 мл воды. Охладить суспензию до 0 оС и пропустить в нее при охлаждении сернистый газ. Температуру жидкости проверять, не давая ей повышаться.
Полученный раствор дитионата марганца с остатками диоксида слить в чашку, нагреть и прилить к нему небольшими порциями горячий раствор 20 г гидроксида бария в 30 мл воды до окончания реакции.
Раствор профильтровать и упарить на водяной бане до начала кристаллизации.
Выпавший при охлаждении осадок отфильтровать на воронке Бюхнера, промыть и высушить.
Задания
1. Нарисуйте узел для получения SO2.
2. Чем охладить суспензию?
3. Почему температура жидкости может повыситься?
4. Что образуется при добавлении гидроксида бария?
5. Как убедиться, что реакция с гидроксидом бария прошла до конца?
6. От чего отфильтровывают раствор в первый раз?
Дитионат натрия
К концентрированному раствору дитионата бария прилить раствор сульфата или карбоната натрия. Осадок отфильтровать, фильтрат упарить на водяной бане до начала кристаллизации. После охлаждения отфильтровать продукт и высушить.
Задания
1. Рассчитайте, сколько сульфата натрия и карбоната натрия нужно взять на 1 г дитионата бария.
2. Оцените, сколько воды потребуется для приготовления концентрированного раствора дитионата бария из 1 г кристаллогидрата.
3. От чего отфильтровывают раствор в первый раз?