Научный руководитель: Л.А. Ваймугин, ХФ МГУ
Согласно правилу Вант-Гоффа при увеличении температуры на каждые 10 градусов скорость химической реакции возрастает в 2 — 4 раза. Данное правило — эмпирическая закономерность, соответственно, у него должны быть условия применимости.
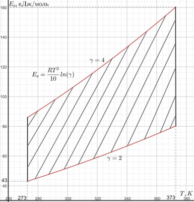
В данной работе с помощью уравнения Аррениуса и математических преобразований были выведены точные границы применения правила Вант-Гоффа для температур от 0 до 100 ℃. Если энергия активации реакции и температура удовлетворяют равенству Е = RT2/10 lnγ при 2≤γ≤4, то есть точка принадлежит области на графике энергии активации от температуры (Рис.1), то правило Вант-Гоффа можно использовать.
Из рис. 1 видно, что правило Вант-Гоффа справедливо в случае химических реакций, для которых характерны относительно невысокие значения энергии активации. Для реакций, характеризующихся высокими значениями энергии активации, температурный коэффициент больше 4, а низкими — меньше 2.
Расчёты с использованием справочных данных (температурных коэффициентов реакций [1] и энергий активации [2]) установили, что в основном правило Вант-Гоффа справедливо для реакций в растворе для температур от 0 до 100 ℃. Для реакций при более высокой температуре правило даёт большую (более 40%) погрешность по отношению к уравнению Аррениуса.
Список литературы
[1] М. С. Захарьевский. Кинетика и катализ : Учеб. пособие для ун-тов / Ленингр. ордена Ленина гос. ун-т им. А. А. Жданова. — Ленинград : Изд-во Ленингр. ун-та, 1963. — 314 с. стр.32 [2] Седьмое издание: «Краткий справочник физико-химических величин» под редакцией К.П. Мищенко и А.А. Равделя, Л.: Химия, 1974 г. – 200 стр. Стр.173-175.