Научный руководитель: Аспирант Факультета биоинженерии и биоинформатики Бакшеева Виктория Егоровна
Координатор от СУНЦ МГУ: О.В.Колясников
Ион Са2+ является одним из ключевых факторов, регулирующих основополагающие процессы, протекающие в нервной системе. Кальциевые сигналы способны опосредовать изменения в экспрессии генов, клеточном росте, развитии, выживаемости и апоптозе. Изменение внутриклеточной концентрации иона Са2+ модулирует важнейшие метаболические пути, инициирует явления долговременной синаптической пластичности, а именно долгосрочную депрессию и долгосрочное потенциирование, обуславливающие феномен обучения и памяти. Са2+ играет ключевую роль в передаче нервного импульса, являясь инициатором выброса нейромедиатора. Нейродегенеративные расстройства, связанные с нарушениями в метаболизме Са2+, лежат в основе таких заболеваний, как шизофрения, болезнь Альцгеймера, биполярное аффективное расстройство, синдром ломкой Х-хромосомы (синдром Мартина-Белла) и др.
Передача кальциевых сигналов, а также внутриклеточный транспорт и регуляция концентрации катиона обеспечиваются специализированными Са2+-связывающими белками, выполняющими, в зависимости от степени сродства к катиону, различные функции. Буферные Ca2+-cвязывающие белки отвечают за транспорт и регуляцию внутриклеточной концентрации кальция. Они имеют относительно низкую аффинность к Сa2+, поэтому связывание катиона не инициирует изменение пространственной структуры белка. Сенсорные Са2+-связывающие белки, в свою очередь, проявляют высокое сродство к Са2+, в результате чего происходит специфичное связывание с катионом, инициирующее изменение пространственной конформации сенсора. Вследствие этого Са2+-связывающие сенсорные белки приобретают способность специфически взаимодействовать с белками-мишенями, участвуя в различных сигнальных каскадах. Яркими представителями Са2+-связывающих сенсорных белков являются белки из семейства нейрональных кальциевых сенсоров (НКС).
Выводы
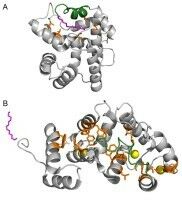
- Наибольший вклад в связывание НКС-1 с мембранами различных фосфолипидных составов вносит миристоильная группа, функционирование которой не является Са2+-зависимым процессом, так как структурные особенности НКС-1 препятствуют обратному захвату миристата после срабатывания Са2+/миристоильного переключателя даже при полном хелатировании Са2+.
- Помимо миристоильной группы в механизме взаимодействия НКС-1 с мембранами участвуют положительно заряженные остатки лизина в 3 и 7 положениях.
- Вклад различных структурных элементов НКС-1 в механизм его взаимодействия с мембранами зависит от их фосфолипидного состава последних. Так, в случае с мембранами гиппокампа по сравнению с фоторецепторными мембранами возрастает роль N-концевой регуляторной последовательности НКС-1.
По материалам работы сделаны выступления на конференциях:
Экспо-выставка MILSET AMLAT (июнь 2016, г. Масатлан, Мексика)