Занятие 12.
Индивидуальная работа.
Синтезы соединений металлов
♦ I. Двойные соли
Хромокалиевые (хромоаммониевые) квасцы
Приготовить примерно 10 % раствор дихромата калия или аммония в 25 мл воды. Прилить концентрированную серную кислоту в полуторном избытке по сравнению с теоретическим расчетом. Смесь охладить до комнатной температуры, потом поставить в воду со льдом.
Пропускать через раствор сернистый газ или приливать из пипетки по каплям этиловый спирт, пока раствор не примет фиолетовую окраску. Следить, чтобы температура не превышала 40 оС.
Выпавшие кристаллы отфильтровать на стеклянном фильтре, промыть холодной водой и высушить. Рассмотреть форму кристаллов под микроскопом и зарисовать их. Определить выход.
Задания
1. Рассчитайте необходимое количество дихромата калия (аммония).
2. Рассчитайте количество раствора серной кислоты (в граммах и миллилитрах).
3. Нарисуйте узел для получения сернистого газа.
4. Напишите 2-3 уравнения реакций получения сернистого газа в этом узле.
5. Нарисуйте узел для пропускания сернистого газа в раствор.
6. Сравните растворимости сульфата калия (аммония) и сульфата хрома с растворимостью квасцов при комнатной температуре. Почему в осадок выпадает двойная соль?
Соль Мора
1 г мелко нарезанной железной проволоки поместить в коническую колбу и растворить при нагревании в 1 М растворе серной кислоты. Объем раствора поддерживать постоянным. По окончании растворения раствор профильтровать и затем упарить до начала появления пленки кристаллов на поверхности.
Приготовить при нагревании насыщенный раствор сульфата аммония. Растворы смешать горячими и оставить кристаллизоваться. Выпавшие в осадок кристаллы отфильтровать на стеклянном фильтре и высушить.
Взвесить продукт, определить выход. Проверить наличие в продукте Fe (III).
Задания
1. Рассчитайте необходимое количество раствора серной кислоты (в граммах и миллилитрах).
2. Как поддерживать постоянным объем раствора?
3. Для чего фильтровать раствор после окончания растворения железа? Какой фильтр следует для этого использовать?
4. Рассчитайте необходимую массу сульфата аммония.
5. Рассчитайте объем горячей (80 оС) воды, необходимый для приготовления насыщенного раствора сульфата аммония.
6. Постройте на одной диаграмме графики растворимости сульфата аммония, сульфата железа (II) и соли Мора. Сравните их растворимости при 80 оС и при комнатной температуре. Почему в осадок выпадает двойная соль?
♦ II. Кристаллогидраты
Кристаллогидраты нитратов магния, кальция, бария, кобальта, марганца
К карбонату магния (кальция, бария, кобальта, марганца) добавить 30-40 % раствор азотной кислоты. Осторожно упарить полученный раствор на водяной бане. Охладить до 0 оС, отфильтровать выпавшие кристаллы и высушить (нитрат магния сушить в эксикаторе над серной кислотой). Взвесить, определить выход.
Кристалл нитрата марганца:
Задания
1. Рассчитать массу и объем раствора азотной кислоты, необходимой для реакции с 1 г карбоната магния (кальция, бария, кобальта, марганца).
2. В какой посуде целесообразно проводить этот синтез?
3. Какие еще соли, кроме нитрата магния, можно сушить в эксикаторе над концентрированной серной кислотой?
Гексагидрат хлорида алюминия
Поместить в стакан 0,5 г свеженапиленного порошка алюминия или фольги, зачищенной наждачной бумагой, и прилить 15 мл 24 % раствора соляной кислоты. Отфильтровать нерастворившийся алюминий. Фильтрат насытить хлороводородом. Отфильтровать выпавший осадок, промыть его концентрированной соляной кислотой. Высушить в эксикаторе над CaCl2, затем быстро поместить во взвешенную пробирку или бюкс и закрыть. Взвесить и определить выход.
Задания
1. Нарисуйте узел для получения хлороводорода.
2. Напишите реакцию получения хлороводорода.
3. Нарисуйте узел для насыщения раствора хлороводородом.
4. Для чего фильтрат насыщают хлороводородом?
5. Для чего алюминиевую фольгу надо зачищать? Почему порошок алюминия должен быть свеженапиленным?
6. Почему продукт быстро изолируют от воздуха?
Гексагидрат хлорида магния
В стакан налить 25 мл 20 % раствора HCl и всыпать небольшими порциями рассчитанное количество оксида магния. Если раствор не прозрачен, профильтровать его. Упарить до половины начального объема, поместить в смесь льда с солью и пропустить через него ток газообразного хлороводорода. Выпавшие кристаллы отфильтровать и высушить при комнатной температуре в эксикаторе над серной кислотой. Взвесить, определить выход.
Задания
1. Рассчитать необходимое количество оксида магния.
2. Почему раствор после реакции может быть непрозрачным?
3. Для чего раствор упаривают?
4. Нарисуйте узел для получения хлороводорода.
5. Напишите реакцию получения хлороводорода в этом узле.
6. Для чего через раствор пропускают хлороводород?
7. Нарисуйте узел для пропускания хлороводорода.
8. Почему кристаллы сушат в эксикаторе?
♦ III. Соединения меди
Хлорид меди (I) (способ 1)
К раствору 3 г CuCl2 добавить при перемешивании конц. HCl. Затем внести в него медные стружки и прокипятить. По окончании реакции образовавшийся раствор вылить в стакан с холодной водой.
Отфильтровать осадок на стеклянном фильтре, следя, чтобы он все время оставался под слоем жидкости. Промыть ацетоном и эфиром до полного удаления воды. Быстро перенести во взвешенный бюкс или запаять во взвешенную ампулу. Определить выход.
СuCl + KOH:
CuCl + NH3 (при стоянии):
Задания
1. Рассчитайте количество воды, необходимое для растворения хлорида меди.
2. Рассчитайте массу и объем раствора HCl.
3. Рассчитайте необходимую массу медных стружек.
4. Почему осадок выпадает при разбавлении, а не наоборот?
5. Почему фильтруемый продукт должен находиться под слоем жидкости? Почему его нужно промывать до удаления воды?
Хлорид, бромид, иодид меди (I) (способ 2)
Растворить 5 г медного купороса в минимальном объеме воды и добавить KСl (KBr, KI). Присыпать рассчитанное количество сульфита натрия и подкислить серной кислотой (или пропускать в теплый раствор газообразный SO2 до окончания выпадения осадка).
Если осадок сразу не выпадает, медленно разбавить реакционную смесь. Отфильтровать осадок на стеклянном фильтре, следя, чтобы он все время оставался под слоем жидкости. Промыть ацетоном до полного удаления воды. Быстро перенести во взвешенный бюкс или запаять во взвешенную ампулу.
Задания
1. Рассчитайте объем воды, необходимый для растворения 5 г медного купороса.
2. Рассчитайте необходимые количества KCl (KBr, KI) и Na2SO3.
3. Почему при невыпадении осадка реакционную смесь разбавляют, а не наоборот?
4. Почему фильтруемый продукт должен находиться под слоем жидкости? Почему его нужно промывать до удаления воды?
♦ IV. Соединения хрома
Ацетат хрома (II)
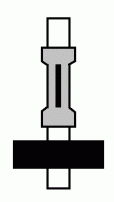
Приготовить пробирку с клапаном Бунзена (рис. 21), т. е. пробкой с резиновой газоотводной трубкой, которая заткнута стеклянной палочкой и надрезана сбоку.
Рис. 21. Клапан Бунзена
В этой пробирке, при охлаждении водой, к 1 г зеленого хлорида хрома (III) добавить конц. HCl и избыток цинка. Восстанавливать до прекращения бурного выделения водорода.
Открыв пробку, быстро влить содержимое пробирки в насыщенный раствор ацетата натрия.
Коктейль Парулавы:
Задания
1. Для чего нужен клапан Бунзена?
2. Зачем пробирку охлаждают водой?
3. Рассчитать, сколько требуется цинка (в граммах) и раствора HCl (в граммах и миллилитрах).
4. Рассчитать необходимое количество ацетата натрия и объем воды, нужный для его растворения (растворимость CH3COONa×3H2O при 20 оС 46,5 г безводной соли на 100 г воды).
5. Какое строение имеет ацетат хрома (II)?
Хромовый ангидрид
1 г дихромата калия растворить при небольшом нагревании в фарфоровой чашке в 10 мл воды. При помешивании стеклянной палочкой добавить 6 мл концентрированной серной кислоты. Охладить раствор, дать постоять 2 часа и отфильтровать осадок на стеклянном фильтре.
Несколько кристаллов хромового ангидрида положить на крышку тигля и прилить 2-3 капли спирта (осторожно!).
Растворить часть хромового ангидрида в воде. Доказать, какие ионы находятся в растворе.
Задания
1. Почему дихромат калия растворяют при нагревании?
2. Для чего раствор оставляют стоять?
3. Почему осадок фильтруют на стеклянном фильтре, а не на бумажном?
4. Какие ионы находятся в водном растворе хромового ангидрида? Как доказать их присутствие?
Хлорид хромила
В сухой пробирке Вюрца смешать 1 г хлорида натрия с 1 г дихромата калия, добавить несколько капель концентрированной серной кислоты, закрыть пробкой. Отвод пробирки Вюрца опустить в сухую пробирку, охлаждаемую холодной водой. Слегка нагреть реакционную смесь.
Часть продукта растворить в воде. Доказать, какие ионы находятся в растворе.
Задания
1. Какую роль играет серная кислота?
2. Что образуется при растворении продукта в воде?
3. Как это доказать экспериментально?
4. Какое строение имеет хлорид хромила?
Триоксалатохромат (III) калия
Растворить 3 г оксалата калия и 7 г щавелевой кислоты в 100 мл воды. К раствору добавить при сильном перемешивании небольшими порциями 2,5 г дихромата калия. По окончании реакции раствор упарить до появления кристаллов на поверхности и оставить для кристаллизации.
Кристаллы отфильтровать, рассмотреть под микроскопом и зарисовать. Определить выход.
Задания
1. Какое строение имеет триоксалатохромат (III) калия?
2. С помощью какого прибора следует проводить упаривание раствора?
3. Какие ионы присутствуют в водном растворе триоксалатохромата (III) калия? Как это доказать экспериментально?
Дихромат аммония
В небольшой конической колбе или большой пробирке растворить 4 г CrO3 в 5-6 мл воды. Охлаждая колбу (пробирку) проточной водой, при постоянном перемешивании прилить из мерной пипетки 10-15 % раствор аммиака. Конец пипетки опустить прямо в раствор. Полученный раствор упарить, охладить, отфильтровать выделившиеся кристаллы.
Задания
1. Что получается при растворении хромового ангидрида в воде?
2. Почему реакционный сосуд необходимо охлаждать?
3. Рассчитайте необходимый объем раствора аммиака.
4. С помощью какого прибора следует проводить упаривание раствора?
Трихромат калия (способ 1)
1/6 пробирки дихромата калия растворить в 25 мл 80 % азотной кислоты и упаривать 10-15 минут, затем добавить минимальное количество воды. Отфильтровать осадок и упарить раствор. Выпавшие кристаллы отфильтровать на стеклянном фильтре, сразу же запаять в ампулу.
Задания
1. Какова масса дихромата калия в 1/6 пробирки?
2. С помощью какого прибора следует проводить упаривание раствора?
3. Зачем после упаривания добавляют воду?
4. Почему продукт необходимо фильтровать на стеклянном фильтре?
5. Почему продукт нужно сразу запаять в ампулу?
Трихромат калия (способ 2)
Приготовить при нагревании насыщенные растворы 1,1 г дихромата калия и 1,7 г CrO3, слить растворы. Упарить полученный раствор вдвое при 60 оС. Выпавшие кристаллы (еще теплые) декантировать и отжать. Продукт запаять в ампулу.
Задания
1. Что получается при растворении хромового ангидрида в воде?
2. Рассчитайте объемы воды, необходимые для получения насыщенных растворов дихромата калия и CrO3.
3. С помощью какого прибора следует проводить упаривание раствора?
4. Что такое декантация?
5. Почему продукт нужно сразу запаять в ампулу?